Lesiones durales y cefalea pospunción dural
Miguel Angel Reina - Hospital Universitario Madrid Montepríncipe.
José Antonio de Andrés - Hospital Universitario General de Valencia.
Alberto Prats - Unidad de Anatomía y Embriología. Facultad de Medicina. Universidad de Barcelona.
J. Castedo - Unidad de Neurorradiología. Hospital Universitario Madrid Torrelodones.
1. INTRODUCCIÓN
La hipotensión de líquido cefalorraquídeo relacionada con una punción lumbar se produce por la fuga del líquido cefalorraquídeo1-2, y esta fuga, con el tamaño de la lesión producida en el saco dura-aracnoideo3. En estudios “in vitro” se ha intentado medir el volumen de fuga de forma indirecta4-8, pero los resultados obtenidos no reflejaban la situación real de la pérdida del líquido cefalorraquídeo durante las horas y los días siguientes a la punción dural, momento en el que aparece y se mantiene la clínica de la cefalea. A lo largo del tiempo, el flujo disminuía de forma exponencial, después de retirar la aguja, a medida que se producía la retracción y el cierre del orificio.
2. MORFOLOGÍA DE LAS LESIONES DURA-ARACNOIDEAS
La morfología de las lesiones producida por las agujas Whitacre y Quincke es diferente9-11. La lesión por agujas punta de lápiz Whitacre se caracteriza por bordes irregulares y una gran destrucción de láminas durales, mientras que la producida por agujas “biseladas” tipo Quincke tiene forma de “U” o “V”, como la tapa de una lata, con bordes de corte regulares. Las lesiones producidas de forma accidental por las agujas epidurales 17-G Tuohy actuales, depende del diseño de la punta y tipo de curva3. Algunas adoptan forma de “C” con bordes regulares, que rápidamente tiende a cerrarse.
El área de las lesiones producidas por la aguja Quincke 25-G es similar al producido por la aguja Whitacre 25-G, no encontrándose diferencias estadísticamente significativas entre las áreas de las lesiones de las láminas durales, ni de la lámina aracnoidea10 (Figuras 1, 2, 3 , 4, 5 y 6).

Fig. 1
Lesión dura-aracnoidea producida con aguja 25-G tipo Quincke. Superficie dural. Microscopia electrónica de barrido 200x Barra 100 micrones. Revista Argentina de Anestesiología 2008;66:6-26. Con permiso.
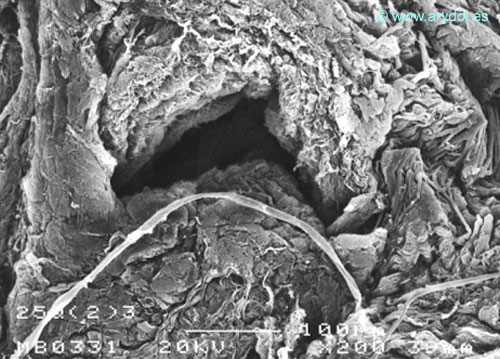
Fig. 2
Lesión dura-aracnoidea producida con aguja 25-G tipo Quincke. Superficie dural. Microscopia electrónica de barrido 200x Barra 100 micrones. Revista Argentina de Anestesiología 2008;66:6-26. Con permiso.

Fig. 3
Lesión dura-aracnoidea producida con aguja 25-G tipo Quincke. Superficie dural. Microscopia electrónica de barrido 200x Barra 100 micrones. Revista Argentina de Anestesiología 2008;66:6-26. Con permiso.
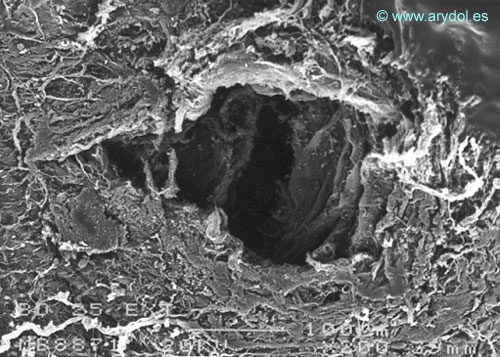
Fig. 4
Lesión dura-aracnoidea producida con aguja 25-G tipo Whitacre. Superficie dural. Microscopia electrónica de barrido 200x Barra 100 micrones. Con permiso del autor. Publicado en Revista Española de Anestesiología y Reanimación 1997; 44:56-61. Con permiso.
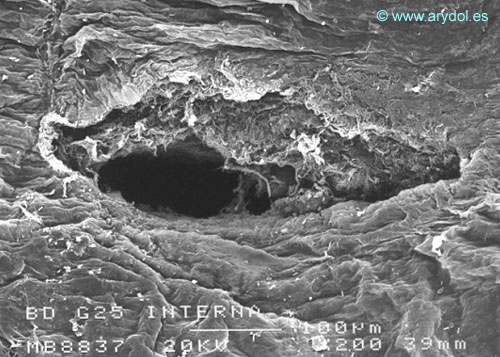
Fig. 5
Lesión dura-aracnoidea producida con aguja 25-G tipo Whitacre. Superficie aracnoidea. Microscopia electrónica de barrido 200x Barra 100 micrones. Con permiso del autor. Publicado en Revista Española de Anestesiología y Reanimación 1997; 44:56-61. Con permiso.

Fig. 6
Lesión dura-aracnoidea producida con aguja 25-G tipo Whitacre. Superficie aracnoidea. Microscopia electrónica de barrido 200x Barra 100 micrones. Con permiso del autor. Publicado Revista Española de Anestesiología y Reanimación 1997; 44:56-61. Con permiso.
Con respecto a la alineación paralela o perpendicular entre el bisel de la punta de la aguja Quincke 22-G y 25-G, y el eje del saco dural, tampoco existieron diferencias estadísticamente significativas entre el área de las lesiones durales, y el área de las lesiones de la lámina aracnoidea10-11. A los 15-20 minutos de haber realizado la punción, sólo un 10% a 20% de la lesión3 continúa abierta. La lesión de la lámina aracnoidea tarda más en cerrarse, posiblemente, por estar formada por células, en contraposición a la lesión de la duramadre, cuya reparación es más rápida, posiblemente por su contenido en fibras colágenas y elásticas. Cuando se analizaron las lesiones durales producidas por agujas 22-G Whitacre se observó el mismo patrón encontrado con las agujas 25-G Whitacre, existiendo un rápido cierre de las láminas durales, y un cierre más tardío de la aracnoides laminar (Figuras 7 y 8).
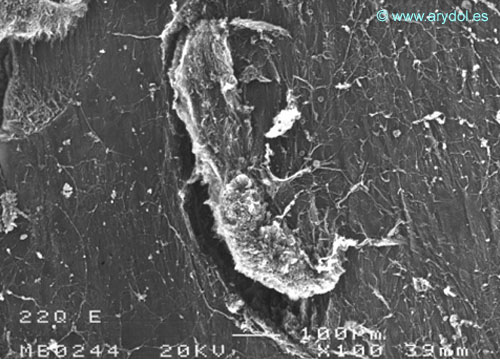
Fig. 7
Lesión dura-aracnoidea producida con aguja 22-G tipo Quincke. Superficie dural. Microscopia electrónica de barrido 100x Barra 100 micrones. Revista Argentina de Anestesiología 2008;66:6-26. Con permiso.
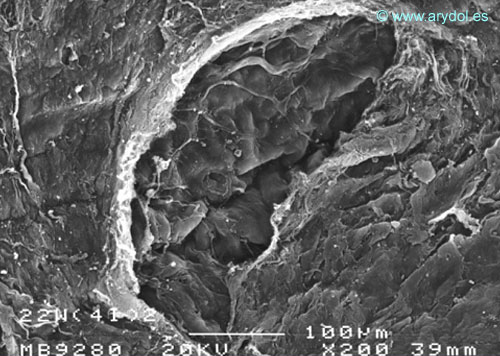
Fig. 8
Lesión dura-aracnoidea producida con aguja 22-G tipo Whitacre. Superficie dural. Microscopia electrónica de barrido 200x Barra 100 micrones. Revista Argentina de Anestesiología 2008;66:6-26. Con permiso.
El factor limitante de las lesiones dura-aracnoideas lo aportaría el componente aracnoideo, por presentar una mayor resistencia a la difusión de líquidos (controla la permeabilidad del saco dural)3. No obstante, su cierre es más lento, ya que está formado principalmente por las células aracnoideas, que no tienen capacidad retráctil. El componente externo o dural aportaría resistencia mecánica a la frágil membrana aracnoidea y un cierre más rápido de la lesión, pero no resolvería la fuga de líquido cefalorraquídeo que difundiría a través del abundante material interfibrilar, constituido principalmente por mucopolisacáridos. La pérdida de líquido cefalorraquídeo dependerá de la retracción y el cierre de la lesión aracnoidea (Figuras 9, 10, 11, 12, 13, 14, 15 y 16).
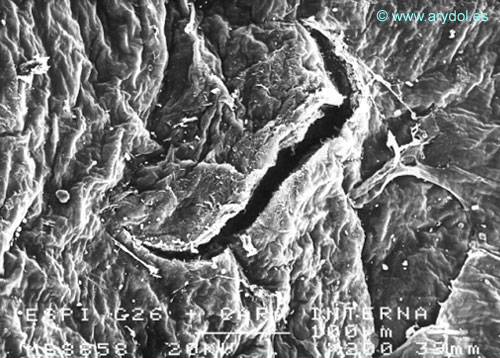
Fig. 9
Lesión dura-aracnoidea producida con aguja 26-G tipo Quincke. Superficie aracnoidea. Microscopia electrónica de barrido 200x Barra 100 micrones.Con permiso del autor. Publicado en Revista Española de Anestesiología y Reanimación 1997; 44:56-61. Con permiso.

Fig. 10
Lesión dura-aracnoidea producida con aguja 26-G tipo Quincke. Superficie aracnoidea. Microscopia electrónica de barrido 150x Barra 200 micrones. Con permiso del autor. Publicado en Revista Española de Anestesiología y Reanimación 1997; 44:56-61. Con permiso.
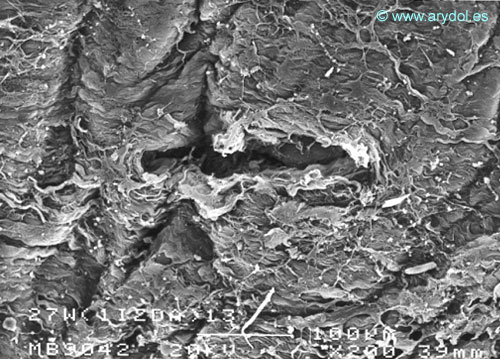
Fig. 11
Lesión dura-aracnoidea producida con aguja 27-G tipo Whitacre. Superficie dural. Microscopia electrónica de barrido 200x Barra 100 micrones. Revista Argentina de Anestesiología 2008;66:6-26. Con permiso.

Fig. 12
Lesión dura-aracnoidea producida con aguja 27-G tipo Whitacre. Superficie dural. Microscopia electrónica de barrido 200x Barra 100 micrones. Revista Argentina de Anestesiología 2008;66:6-26. Con permiso.
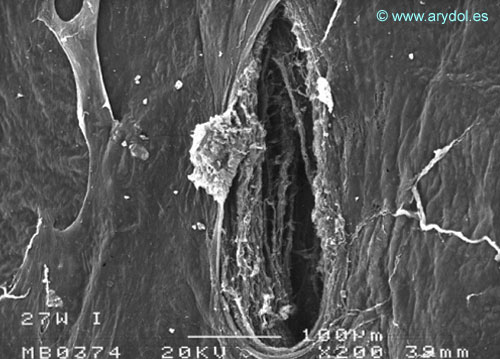
Fig. 13
Lesión dura-aracnoidea producida con aguja 27-G tipo Whitacre. Superficie aracnoidea. Microscopio electrónica de barrido 200x Barra 100 micrones. Revista Argentina de Anestesiología 2008;66:6-26. Con permiso.
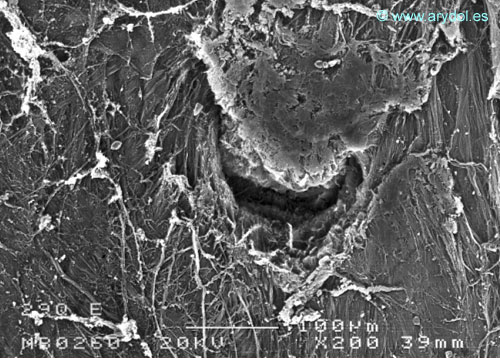
Fig. 14
Lesión dura-aracnoidea producida con aguja 29-G tipo Quincke. Superficie dural. Microscopia electrónica de barrido 200x Barra 100 micrones. Revista Argentina de Anestesiología 2008;66:6-26. Con permiso.
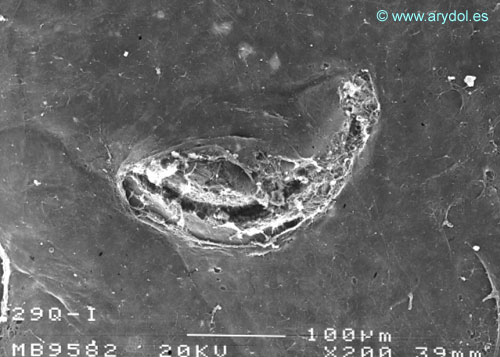
Fig. 15
Lesión dura-aracnoidea producida con aguja 29-G tipo Quincke. Superficie aracnoidea. Microscopia electrónica de barrido 200x Barra 100 micrones. Revista Argentina de Anestesiología 2008;66:6-26. Con permiso.
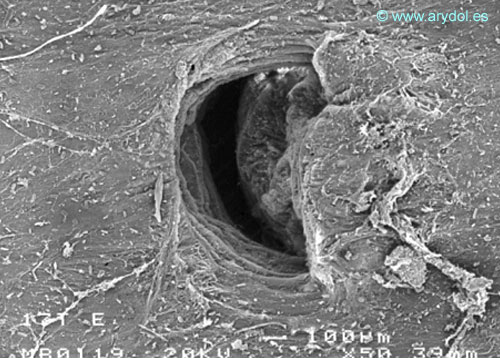
Fig. 16
Lesión dura-aracnoidea producida con aguja 29-G tipo Quincke. Superficie aracnoidea. Microscopia electrónica de barrido 200x Barra 100 micrones. Revista Argentina de Anestesiología 2008;66:6-26. Con permiso.
Los resultados de las lesiones durales “in vitro” no tienen una correspondencia directa con los estudios clínicos. En éstos, la frecuencia de cefalea pospunción dural disminuye con el uso de agujas “punta de lápiz”. Posiblemente hay otros factores implicados. La resistencia mecánica de la punta de una aguja está influida por su diseño. Una punta cónica no se deforma, sin embargo, una aguja “biselada” sí lo hace cuando contacta con el hueso, adquiriendo un diseño nuevo e impredecible en el próximo intento por alcanzar al saco dural.
Por el contrario, una aguja “punta de lápiz” continúa manteniendo su diseño de punta original tras sucesivas aplicaciones.
La mayor destrucción tisular que puede producir una aguja “punta de lápiz” respecto al corte limpio que se observa con agujas tipo Quincke, posiblemente se traduzca en una mayor reacción inflamatoria localizada y edema asociado, que ocluye de forma más temprana la lesión. Las agujas “biseladas” tipo Quincke se deforman con facilidad si chocan contra el hueso. Esta deformación originaría un nuevo diseño de punta más lesivo.
3. CAMBIOS MORFOLÓGICOS EVALUADOS EN IMÁGENES DE RESONANCIA MAGNÉTICA
La resonancia magnética aporta imágenes con signos radiológicos característicos en los pacientes que cursan con hipotensión de líquido cefalorraquídeo12. En estas imágenes se puede evaluar el descenso del encéfalo y de las amígdalas cerebelosas, el tamaño de las diferentes cisternas subaracnoideas y de los ventrículos intracerebrales, modificaciones en el tamaño de la hipófisis, el engrosamiento de las meninges craneales y la existencia de higromas o hematomas subdurales13. Estos cambios ocurren simultáneamente y pueden estar presentes en parte o en su totalidad, dependiendo del grado de hipotensión de líquido cefalorraquídeo.
Cambios en la posición del encéfalo
Para evaluar el descenso del encéfalo se examina: 1) la posición del inicio del acueducto de Silvio, que comunica el tercer y cuarto ventrículos, respecto a una línea imaginaria trazada entre las apófisis clinoides anteriores y el punto de confluencia de los senos recto y sagital inferior con la vena cerebral magna; y 2) la posición de las amígdalas cerebelosas respecto a la línea que se extiende desde la porción inferior del clivus hasta el labio posterior del foramen magnum (línea del foramen magnum o de McRae).
Engrosamiento meníngeo
En los casos de hipotensión intracraneal se produce un engrosamiento meníngeo (Figura 17).
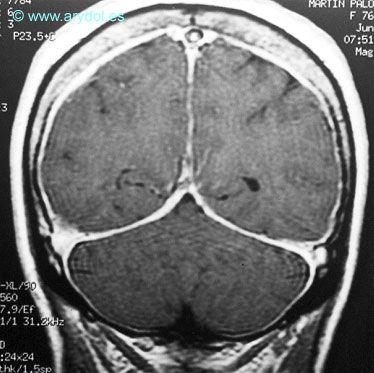
Fig. 17
Engrosamiento meníngeo en un paciente con síndrome de hipotensión intracraneal. Resonancia magnética. Publicado en Revista Española de Anestesiología y Reanimación 2002;49:89-100. Con permiso.
Probablemente este engrosamiento responda a una mayor captación de gadolineo por los vasos meníngeos, dilatados para compensar la hipotensión del líquido cefalorraquídeo.
Cambios de la hipófisis
El agrandamiento se podría deber a una vasodilatación de los vasos localizados en el espesor de la glándula secundaria a la fuga de líquido cefalorraquídeo. No obstante, la hipófisis retorna a su tamaño normal cuando la clínica de cefalea desaparece (Figuras 18 y 19).
Modificaciones en el tamaño de las cisternas subaracnoideas y ventrículos cerebrales
El volumen total del líquido cefalorraquídeo resulta de un equilibrio dinámico entre su producción y su reabsorción. Cuando la pérdida supera la formación de líquido cefalorraquídeo, se produce una disminución del tamaño de las cisternas subaracnoideas y de los ventrículos cerebrales (Figuras 18 y 19).
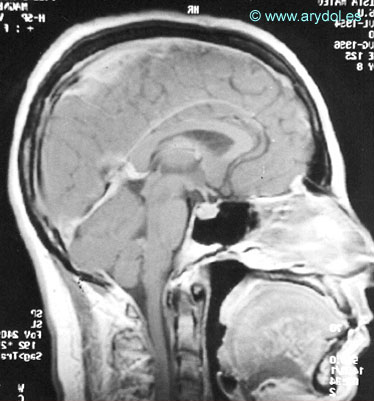
Fig. 18
Cambios morfológicos encontrados en un paciente con síndrome de hipotensión intracraneal con clínica de cefalea. Resonancia magnética Publicado en Revista Española de Anestesiología y Reanimación 2002;49:89-100. Con permiso.
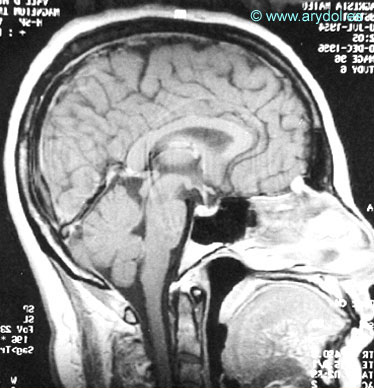
Fig. 19
Cambios morfológicos encontrados en un paciente con síndrome de hipotensión intracranealen la resonancia magnética cuando cede la cefalea. Resonancia magnética Publicado en Revista Española de Anestesiología y Reanimación 2002;49:89-100. Con permiso.
Hematomas subdurales craneales
La tracción del encéfalo sobre la aracnoides lleva a la rotura de las células neuroteliales del compartimento subdural craneal. Junto a estas células se rompen lo pequeños vasos que atraviesan el espesor de este compartimento, dando origen al hematoma subdural13.
Correlación clínico radiológica
Mientras persiste la clínica pueden aparecer los cambios morfológicos descritos. Cuando la clínica desaparece, probablemente porque la formación de líquido cefalorraquídeo compensa las pérdidas existentes, y el encéfalo retorna a la situación normal, también desaparecen los hallazgos radiológicos. 4.
4. BIBLIOGRAFÍA
- Benito-León J, Reina MA, Álvarez-Linera J. El síndrome de hipotensión intracraneana. Neurología 2001;16:418-426.
- Reina MA, Benito-León J, López A. Profilaxis del síndrome de hipotensión intracraneal y cefalea pospunción lumbar. Neurología 2002;17:347-349.
- Reina MA, Castedo J, López A. Cefalea pospunción dural. Ultraestructura de las lesiones durales y agujas espinales usadas en las punciones lumbares. Rev Arg Anestesiol. 2008;66:6-26.
- Cruickshank RH, Hopkinson JM. Fluid flow through dural punctures sites. An in vitro comparison of needle point types. Anaesthesia 1989;44:415-418.
- Ready LB, Cuplin S, Haschke RH, Nessly M. Spinal needle determinants of rate of transdural fluid leak. Anesth Analg. 1989;69:457-460.
- Janes EF, Pennefather S, Wilkinson K. Fluid flow through dural punctures sites. Anaesthesia 1989;44:1011.
- Morrison LMM, McCrae AF, Foo I, Scott DB, Wildsmith JAW. Reg Anesth. 1996;21:139-146.
- Holst D, Möllman M, Ebel C, Hausman R Wendt M. In vitro investigation of cerebrospinal fluid leakage after dural puncture with various spinal needles. Anesth Analg. 1998;87:1331-1335.
- Reina MA, Lopez A, Badorrey V, De Andres JA, Martín S. Dura-arachnoids lesions produced by 22G Quincke spinal needles during a lumbar puncture. J Neurol Neurosurg Psychiatry 2004;75:893-897.
- Reina MA, De León Casasola OA, López A, De Andrés JA, Martín S, Mora M. An in vitro study of dural lesions produced by 25 Gauge Quincke and Whitacre needles evaluated by scanning electron microscopy. Reg Anesth Pain Med. 2000;25:393-402.
- Reina MA, López A, De Andrés JA, Dittmann M, Cascales M, Del Caño MC, Daneri J, Zambrano O. Estudio en cadáveres mediante microscopia electrónica de barrido de la lesión dural producida por la aguja Whitacre y Quincke. Rev Esp Anestesiol Reanim. 1997;44:56-61.
- Reina MA, Álvarez-Linera J, López A, Benito-León J, De Andrés JA, Sola RG. Aportaciones de la resonancia magnética en la cefalea pospunción dural y en pacientes que cursan con hipotensión de líquido cefalorraquídeo. Rev Esp Anestesiol Reanim. 2002;49:89-100.
- Reina MA, López A, Benito-Leon J, Pulido P, María F, Hematoma subdural intracraneal y espinal, una complicación poco común de la anestesia epidural y subaracnoidea. Rev Esp Anestesiol Reanim. 2004;51:28-39.