Complicaciones de la anestesia regional
1. INTRODUCCIÓN
En la última década, y en particular en los últimos 5 años, se ha producido un incremento significativo en lapráctica de la anestesia regional. Este crecimiento afecta tanto al número de anestesiólogos que realizan estas técnicas como al número de procedimientos quirúrgicos realizados bajo anestesia regional y podría dar lugar a un aumento de las complicaciones y efectos adversos1. Las complicaciones pueden dividirse en aquellas derivadas de la práctica de bloqueos centrales (intradural, epidural e intraepidural) y complicaciones relacionadas con los bloqueos nerviosos periféricos (BNP), a las cuales vamos a referirnos a continuación.
En los últimos años se ha producido un aumento en el interés de los anestesiólogos por los BNP. Esto puede estar relacionado con la disponibilidad de nuevos fármacos y de materiales, así como con la existencia de evidencias científicas que relacionan los BNP con un mejor control del dolor24, reducción en la incidencia de náuseas y vómitos y en la estancia hospitalaria2,5, con la obtención de mejores resultados quirúrgicos6 y una mayor satisfacción del paciente7,8. Esto ha favorecido el aumento en el número de BNP realizados en los últimos años y puede conllevar un incremento en la frecuencia de aparición de complicaciones relacionadas con estas técnicas.
Si bien los principales artículos encontrados en las bases de datos bibliográficas sobre complicaciones de los BNP están resumidos en la tabla 1, el contenido desarrollado a continuación está basado fundamentalmente en las publicaciones de Auroy y col8,9, Fanelli y col10, Hadzic y col11 y Borgeat y col12,13.
2. INCIDENCIA
Actualmente la incidencia global de complicaciones relacionadas con la práctica de los BNP es baja y oscila entre 0 y 5%, siendo comunicadas con mayor frecuencia tras bloqueos del plexo braquial que tras bloqueos de la extremidad inferior14. Esto puede estar relacionado con el hecho de que el bloqueo del plexo braquial es una de las técnicas más prevalente en la práctica clínica y con algunas variaciones anatómicas del plexo braquial, sobre todo a nivel axilar. En general, las complicaciones de los BNP pueden ser agrupadas en cinco categorías principales: neuropatía periférica, convulsiones, insuficiencia respiratoria, parada cardíaca y muerte8,9.
Un estudio publicado por Auroy y col8 intenta determinar la incidencia de complicaciones producidas por la anestesia locorregional, en general, y por los BNP, en particular, a partir de una declaración prospectiva de todas las técnicas regionales desarrolladas por anestesiólogos franceses. Actualmente, en España, los anestesiólogos contamos con una página web (www.sosalrspain.com)14 en la que comunicar posibles complicaciones relacionadas con la práctica de la anestesia regional en general y de BNP en particular, y que además nos ofrece la opinión de expertos sobre éstas. SOS-ALR España14 está en funcionamiento desde noviembre de 2002 con la finalidad de favorecer la divulgación de la anestesia locorregional, centrando su atención en las incidencias derivadas de la aplicación de las técnicas locorregionales. El equipo de SO-SALR España14 está formado por anestesiólogos de diferentes hospitales españoles especialmente interesados y formados en anestesia locorregional.
Auroy y cols9, en un período de 10 meses, registraron 50.223 BNP. Las complicaciones comunicadas y su relación con las diferentes técnicas fueron las siguientes:
En la extremidad superior:
- 4 casos de neuropatía: 1 tras un bloqueo interescalénico (2.9/10.000), 2 tras un bloqueo axilar (1.8/10.000) y 1 tras un bloqueo mediohumeral (1.4/10.000).
- 3 casos de convulsiones: 1 tras un bloqueo supraclavicular (5.3/10.000), 1 tras un bloqueo axilar (0.9/10.000) y 1 tras un bloqueo mediohumeral (1.4/10.000).
En la extremidad inferior:
- 8 casos de neuropatía: 3 tras un bloqueo femoral (2.9/10.000), 2 tras un bloqueo ciático proximal (2.4/10.000) y 3 tras un bloqueo ciático poplíteo (31.5/10.000).
- 3 casos de convulsiones: 1 tras un bloqueo del plexo lumbar por vía posterior (25.4/10.000) y 2 tras un bloqueo ciático proximal (2.4/10.000).
- 2 casos de insuficiencia respiratoria tras un bloqueo del plexo lumbar por vía posterior (50.8/10.000).
- 1 caso de parada cardíaca tras un bloqueo del plexo lumbar por vía posterior (25.4/10.000).
- 1 caso de muerte tras un bloqueo del plexo lumbar por vía posterior (25.4/10.000).
Si bien los autores no tienen la seguridad de que todas las complicaciones hayan sido comunicadas, sí consideran que este estudio9 pudo ser útil para un mejor registro de éstas. Su principal aportación fue la comunicación de una elevada (80/10.000) incidencia de complicaciones severas en relación con el bloqueo del plexo lumbar por vía posterior.
La etiología de las complicaciones de los BNP es frecuentemente multifactorial15-18. Éstas pueden estar producidas por la cirugía, enfermedades subyacentes y otros factores, además de por el propio bloqueo nervioso 10,12,17,18. Shah y col19 han comunicado, recientemente, un caso de lesión permanente del nervio ciático tras un bloqueo mediante un abordaje anterior, en el que se determinó que la lesión producida en el nervio ciático fue a nivel del muslo coincidiendo con el sitio de inserción de la aguja. Un análisis de las demandas relacionadas con las lesiones nerviosas y la anestesia puso de manifiesto una asociación con la anestesia general en el 61% de los casos y con la anestesia regional en el 39%20. Los autores de este análisis pensaron que estas lesiones se produjeron sobre todo por compresión y elongación del nervio o plexo en una posición determinada del paciente. Las lesiones nerviosas periféricas tras anestesia general suelen afectar al nervio cubital y plexo braquial, mientras que las lesiones del plexo lumbosacro suelen ocurrir tras bloqueo del neuroeje20.
3. TIPOS DE LESIÓN NERVIOSA
Actualmente se reconocen tres tipos diferentes de lesión nerviosa periférica21:
- Neuropraxia o contusión axonal: representa una agresión neural de grado medio que es reversible y se manifiesta en la electroneuromiografía mediante un descenso en la velocidad de conducción nerviosa. En ésta no se produce degeneración neuronal periférica, siendo la recuperación total y rápida.
- Axonotmesis o interrupción del axón: ocurre cuando el axón sufre una alteración en su continuidad con preservación del tejido conectivo de soporte (epineuro). Los fenómenos de regeneración comienzan después de 6 semanas a una velocidad de 1-2 mm/24 horas. Generalmente, la recuperación es más favorable en pacientes sanos y jóvenes, así como en casos de lesiones distales. Este tipo de lesión se asocia frecuentemente con compresión relacionada con la posición del paciente, elongación nerviosa y toxicidad de fármacos o concentración elevada de anestésico local.
- Neurotmesis o interrupción del fascículo: representa el grado mayor de afectación nerviosa y consiste en una afectación completa de todas las estructuras de soporte conectivo. Se produce una disrupción y separación de los extremos del nervio lesionado. Este tipo de lesión tiene mal pronóstico en cuanto a la recuperación completa del nervio, ya que ésta es incompleta.
NEUROPATÍA
Aunque las lesiones nerviosas son comúnmente relacionadas con los BNP, actualmente pueden ser más frecuente tras anestesia general y bloqueos centrales12,16,21,22. La lesión nerviosa del plexo braquial es una complicación bien reconocida de los bloqueos realizados a este nivel12,16,18,21,22. Su incidencia es variable y se ha estimado entre un 0% y superior a un 5%12,23. Generalmente, la neuropatía periférica es atribuida al propio bloqueo, si bien esta idea fue desafiada por Selander y col24, que indicaron que otros factores pueden ser responsables de la lesión nerviosa. Su etiología es frecuentemente multifactorial1518. Una proporción relativamente pequeña de las secuelas neurológicas postoperatorias son causadas sólo por los BNP. Por ejemplo, la incidencia de neuropraxia transitoria del plexo braquial puede llegar a ser hasta del 30% tras artroscopia de hombro, siendo el nervio musculocutáneo el componente del plexo braquial más vulnerable. Esto ha sido atribuido a diversos factores quirúrgicos como distensión articular, tracción excesiva y extravasación de fluido durante la cirugía. Los factores quirúrgicos pueden ser la principal etiología del déficit neurológico postoperatorio en hasta el 80% de los casos. La artroplastia total de hombro se asocia con un déficit neurológico postoperatorio en el 43% de los casos, afectándose principalmente el tronco superior del plexo braquial. Es bien conocido que la relevancia clínica de los síntomas de lesión nerviosa puede aparecer dos o tres semanas después de la realización del bloqueo nervioso, lo cual dependerá de la formación de edema perineural, microhematoma y un proceso inflamatorio, que pueden explicar la demora en la aparición de los síntomas. De los 12 casos comunicados por Auroy y col9, 4 ocurrieron en la extremidad superior (1 tras un bloqueo interescalénico, 2 en relación con un bloqueo axilar y 1 después de un bloqueo mediohumeral) y 8 tuvieron lugar en la extremidad inferior (3 tras un bloqueo femoral, 2 después de un bloqueo ciático proximal y 3 en relación con un bloqueo ciático poplíteo). De estos 12 casos, 7 presentaron secuelas después de 6 meses y en 9 pacientes la técnica fue realizada mediante neuroestimulación, de los cuales 2 refirieron parestesia durante la manipulación con la aguja y en 3 pacientes se emplearon intensidades de estimulación inferiores a las habituales.
Urban y col26, en un estudio prospectivo observacional, realizado en 508 pacientes que recibieron un bloqueo interescalénico (n=266) o un bloqueo axilar (n=242) para cirugía de la extremidad superior, determinaron una incidencia de parestesia postoperatoria posterior a un bloqueo interescalénico en el 9% (24/266), que descendió a un 3% (8/266) dos semanas después. En el grupo de pacientes que recibieron un bloqueo axilar la incidencia de parestesia postoperatoria fue superior, del 19% (46/242).
En general, las complicaciones nerviosas tras un BNP no son estudiadas de forma prospectiva mediante electroneuromiografía. Éste es un método que mide los cambios en un nervio periférico por combinación de la electromiografía de un músculo, con la estimulación eléctrica del tronco nervioso que contiene las fibras nerviosas que llegan hasta ese músculo. En este sentido, Borgeat y col12 realizaron una electromiografía a 50 pacientes sometidos a un bloqueo interescalénico ante la sospecha de lesión nerviosa. De ellos, 31 tuvieron un registro normal y todos los pacientes se recuperaron completamente al final del período de estudio, que duró 9 meses. Es difícil explicar las razones de la persistencia de las parestesiasdisestesias en estos pacientes, ya que la electroneuromiografía no puso de manifiesto disminución de la velocidad de conducción, que es uno de los signos más precoces de la neuropraxia, la forma menos severa de lesión nerviosa. Realmente, no es conocido si esto representa alguna forma de traumatismo quirúrgico o puede ser secundario a la posición del paciente. Las complicaciones registradas a medio y largo plazo fueron: síndrome de compresión cubital 1.5% (8/521)27, síndrome de túnel carpiano 0.8% (4/521), neuropatía del plexo braquial 0.2% (1/521), plexopatía severa 0.2% (1/521) y síndrome de dolor regional complejo 1% (l5/521)28. Estas complicaciones deben ser tenidas en cuenta tras un bloqueo interescalénico ante la presencia de parestesias, disestesias o dolor no relacionado con la cirugía, ya que su diagnóstico precoz puede ser determinante en la obtención de los mejores resultados terapéuticos.
Fanelli y col10, en un estudio multicéntrico observacional, en el que se incluyeron 3996 BNP, determinaron una incidencia de disfunción neurológica en la extremidad intervenida, durante el primer mes tras la cirugía, del 1,7% (69 casos). La completa recuperación de la función neurológica se evidenció en todos los pacientes en los tres primeros meses posteriores a la intervención, excepto en un caso. Dicho paciente refirió dolor y disestesia en la cara anterior del muslo y pérdida de fuerza en el cuádriceps femoral durante 25 semanas tras la realización de la técnica. Además, un estudio electrofisiológico realizado tres meses después de la intervención puso de manifiesto una lesión del nervio periférico en la distribución del nervio femoral. En este estudio10 la incidencia relativa de disfunción neurológica fue mayor en pacientes sometidos a un bloqueo interescalénico que en los que se sometieron a un bloqueo axilar. La incidencia fue similar en aquellos que se sometieron a un bloqueo femoral o a un bloqueo ciático. De los diferentes factores analizados, sólo la presión del torniquete neumático de isquemia se relacionó con un incremento significativo en el riesgo de lesión nerviosa transitoria, cuando la presión de inflado fue superior a 400 mmHg. El torniquete neumático de isquemia para producir un campo quirúrgico libre de sangre es ampliamente utilizado en la práctica clínica. Makitie y col29 estudiaron las velocidades de conducción nerviosa y motora en el nervio ciático de la rata entre 1 y 90 días, después de períodos de isquemia comprendidos entre 1 y 6 horas. Observaron una ligera disminución de la velocidad de conducción motora durante el primer día, a partir de 1 ó 2 horas de isquemia y un bloqueo completo de la conducción entre 3 y 6 horas de isquemia. La disminución en la velocidad de conducción nerviosa se observó primero tras 2 horas de isquemia y un bloqueo completo de ésta se registró entre 4 y 6 horas de isquemia. Tanto la velocidad de conducción nerviosa como la velocidad de conducción motora se normalizaron a los 90 días. Otros autores han puesto de manifiesto que presiones comprendidas entre 250 y 500 mmHg no producen bloqueo en la conducción nerviosa30 y que entre 50 y 200 mmHg de presión se producen alteraciones en la permeabilidad microvascular del nervio periférico, sobre todo en el margen de compresión31, lo cual produce edema e incremento en la presión de fluido endoneural, dificultando la nutrición tisular. Estos cambios pueden relacionarse con alteraciones clínicas y retraso en la recuperación postoperatoria tras cirugía en una extremidad con torniquete de isquemia inflado a una presión elevada. Brull R y cols32 han estimado la incidencia de neuropatía tras un BNP en un 3%, siendo muy rara la lesión neurológica permanente.
4. TOXICIDAD
TOXICIDAD DEL SISTEMA NERVIOSO CENTRAL. CONVULSIONES
Para minimizar el riesgo de toxicidad sistémica por anestésico local se debe administrar la dosis de anestésico más pequeña que asegure un adecuado bloqueo nervioso, así como descartar una inyección intravascular. Algunos autores cifran esta incidencia entre 3,9 y 11 por 10.000 casos8. En los más de 50.000 BNP comunicados por Auroy y col9 se registraron 6 casos de toxicidad sistémica por anestésico local que se manifestaron en el sistema nervioso central mediante convulsiones: 3 de ellos ocurrieron en relación con bloqueos del plexo braquial (1 tras un bloqueo supraclavicular, 1 después de un bloqueo axilar y 1 tras la realización de un bloqueo mediohumeral) y 3 ocurrieron en relación con bloqueos de la extremidad inferior (1 tras un bloqueo del plexo lumbar por vía posterior y 2 después de un bloqueo del nervio ciático proximal).
Brown y col33 comunicaron una incidencia de convulsiones tras anestesia del plexo braquial del 0.2%, similar a la referida por Borgeat y col12, en relación con el bloqueo del plexo braquial a nivel interescalénico.
INSUFICIENCIA RESPIRATORIA
Las complicaciones respiratorias relacionadas con los BNP se han comunicado con muy poca frecuencia. Borgeat y col12, en un estudio en el que incluyeron 521 pacientes sometidos a bloqueo interescalénico, determinaron una incidencia de neumotórax del 0,2% (1 caso) y en el estudio de Auroy y col9 se registraron 2 casos de insuficiencia respiratoria en relación con un bloqueo del plexo lumbar por vía posterior, de los cuales un caso se vio favorecido por la existencia de obesidad mórbida en el paciente que lo sufrió. El bloqueo interescalénico se relaciona con una incidencia muy elevada de parálisis frénica ipsilateral. Urmey y col34 pusieron de manifiesto, mediante ultrasonografía, una incidencia del 100%. Es por ello, por lo cual el abordaje bilateral del plexo braquial a nivel interescalénico se considera contraindicado. Un abordaje supraclavicular del plexo braquial lo constituye el bloqueo interesternocleidomastoideo, descrito por Pham-Dang y col35 en 1997. En este estudio, realizado en 150 pacientes, la incidencia registrada de bloqueo ipsilateral del nervio frénico fue del 60%, siendo en todos los casos asintomática.
PARADA CARDÍACA
En el estudio de Auroy y col9 se registró un caso de parada cardíaca con resultado de muerte tras un bloqueo del plexo lumbar por vía posterior. Inmediatamente antes de la parada se pudo objetivar un nivel de bloqueo sensitivo superior a la segunda vértebra torácica y midriasis bilateral, que se pusieron en relación con una difusión cefálica del anestésico local a nivel de los espacios epidural o subaracnoideo. Esto puede producirse cuando la inyección se realiza en un punto próximo a la salida de las raíces nerviosas por los forámenes intervertebrales.
5. TÉCNICA Y COMPLICACIONES
¿Reduce la neuroestimulación el riesgo de complicaciones?
Si bien una razón importante que apoya el uso de la neuroestimulación en la realización de los BNP es el menor riesgo de provocar un traumatismo nervioso, la verdadera incidencia de complicaciones neurológicas tras un BNP realizado con neuroestimulación aún no se conoce con exactitud. El neuroestimulador se ha convertido en un elemento esencial para la práctica moderna de BNP36,37. En oposición al método clásico de la parestesia38, representa una forma de objetivar la posición relativa de la aguja respecto del nervio. No precisa la colaboración del paciente, y hace más confortable la técnica para el paciente. De esta forma la observación de la respuesta motora deseada a una intensidad de estimulación superior a 0,2 mA e inferior a 0,5 mA puede asegurar una correcta localización de la aguja con pocas molestias para el paciente38. Aún no hay evidencias científicas de que la técnica con neuroestimulación sea superior a la técnica clásica de la parestesia. Sin embargo, en la mayoría de publicaciones sobre BNP la técnica empleada para su realización es la neuroestimulación38-42. La técnica clásica busca la parestesia en el 100% de los casos, mientras que la neuroestimulación produce parestesia accidentalmente en un porcentaje de casos (15-30%) que dependerá de muchas variables entre las que se encuentra la experiencia del anestesiólogo. Las parestesias no son inocuas para el nervio43. Está ampliamente extendido que la observación de una respuesta motora deseada a una intensidad de estimulación baja se corresponde con una íntima relación entre la aguja y el nervio y, por lo tanto, con una mayor tasa de éxitos. Sin embargo, esto es controvertido, ya que una escasa distancia entre la aguja y el nervio puede ser más perjudicial que beneficioso44. Deben evitarse respuestas motoras con una intensidad de estimulación inferior a 0,2 mA, ya que intensidades tan bajas indican casi un contacto entre la punta de la aguja y el nervio, o bien puede indicar una inyección intraneural, si la aguja se ubicó dentro del tejido adiposo del epineuro. En esta situación, y basándonos en la experiencia clínica, se debe retirar lentamente la aguja hasta que la respuesta motora deseada se observe en un rango de intensidad comprendido entre 0,2 mA y 0,5 mA. Actualmente, la intensidad de corriente a la que la aguja está suficientemente cerca del nervio para un bloqueo exitoso, pero a una distancia lo bastante segura como para evitar la lesión del nervio, es desconocida45.
¿Incrementa el riesgo de complicaciones la técnica de inyección múltiple?
La técnica de inyección múltiple proporciona una tasa de éxitos superior a la técnica de inyección única46,47. Sin embargo, la retirada y cambios en la dirección de la aguja para la obtención de múltiples respuestas motoras podrían incrementar, no sólo las molestias del paciente, sino también el riesgo de traumatismo neural y la incidencia de complicaciones neurológicas10. Probablemente, el traumatismo mecánico durante la realización del bloqueo sea el factor que más frecuente se relaciona con la lesión neurológica. Poco se conoce sobre cómo evitar o reconocer la inserción de la aguja en un nervio o una inyección intraneural. Sin embargo, evidencias experimentales48,49 sugieren que la localización intraneural de la aguja se asocia con una resistencia en su avance y que la inyección intraneural se relaciona con un incremento en la presión de la inyección48,49. Hadzic y cols50 han demostrado en un modelo animal que la inyección en el interior del nervio a baja presión, tanto intraepineural como intraperineural, no provoca lesión nerviosa permanente, mientras que presiones de inyección superiores o igual a 11 psi se asociaron con lesión severa y permanente del fascículo nervioso. En este sentido Claudio y cols51 han puesto de manifiesto que la mayoría de los anestesiólogos generan presiones de inyección superiores a 20 psi y un 10% superiores a 30 psi (2 atmósferas). Por tanto, en casos de inyección intraneural, presiones de inyección superiores a 11 psi pueden producir lesión nerviosa permanente. Por lo tanto, para una amplia variedad de bloqueos, velocidades de inyección inferiores a 20 ml/min generan presiones significativamente inferiores. Fanelli y col10, en un estudio multicéntrico en el que incluyeron alrededor de 4.000 BNP con técnica de inyección múltiple observó una incidencia de lesión neurológica del 1.7%, similar a la registrada por Selander y col24 en una serie de más de 500 BNP realizados con técnica de inyección única. Estos últimos encontraron un 1.9% de pacientes que desarrollaron síntomas neurológicos en las tres primeras semanas del postoperatorio, con una duración media de los síntomas de diez meses.
¿Puede influir el bisel de la aguja en la incidencia de complicaciones?
Reina y cols44 estudiaron la interacción de los biseles de las agujas y de los fascículos del nervio ciático humano durante una hipotética parestesia. Según los autores las parestesias pueden aparecer cuando la aguja se introduce a partir de 0,3-0,4 mm de profundidad y su punta rompe el perineuro, penetrando en el fascículo. A 1 mm de profundidad la lesión será mayor con agujas de bisel corto que con agujas de bisel largo. Por tanto, las parestesias pueden desencadenarse por compresión fascicular con lesión superficial que afectará sólo al epineuro y sin alteraciones futuras, o con rotura del perineuro que se asociará a una alteración de la barrera hemato-nerviosa. La mayoría de los expertos coinciden en que las agujas de bisel corto (30º-45º) producen menos lesión nerviosa durante la realización de un BNP que las agujas de bisel largo. Selander y col52 establecieron que el riesgo de perforar un fascículo nervioso es significativamente menor cuando se emplea una aguja de bisel corto. Sin embargo, Rice y Mac Mahon53 pusieron de manifiesto que una vez que la aguja ha penetrado el fascículo nervioso, el traumatismo nervioso es mayor cuando se emplea una aguja de bisel corto. En la actualidad las agujas empleadas con mayor frecuencia son las de bisel corto. El empleo reciente de tecnología de ultrasonidos de alta resolución ha confirmado en tiempo real los hallazgos de Selander y cols52, es decir, cuando un nervio es abordado por una aguja de bisel corto en un espacio anatómico amplio raramente es penetrado por la aguja, siendo desplazado al contactar con ésta. Sin embargo, cuando el nervio es bloqueado en un espacio anatómico reducido, por ejemplo el nervio cubital en el canal epitroclear, puede ser lesionado debido a su menor movilidad. En relación con esto, Marhofer P y col54 han sugerido que el empleo de la ecografía no sólo puede incrementar la tasa de éxito de los bloqueos, sino que también puede evitar las complicaciones relacionadas con la aguja. Otros autores consideran que el contacto aguja-nervio por sí mismo, sin inyección del anestésico local, raramente produce alteraciones clínicas o funcionales. Sin embargo, si además de la penetración el fascículo nervioso por la aguja se produce inyección de anestésico local en su interior, se originará degeneración axonal, con la consiguiente lesión neurológica55.
¿Incrementa el riesgo de complicaciones la colocación de catéteres?
Son diversos los artículos publicados que refrendan la utilidad de los catéteres para prolongar la analgesia en el período postoperatorio56-62. Si bien el riesgo de complicaciones neurológicas relacionadas con el bloqueo axilar de dosis única ha sido bien establecido (0,2-19%), la seguridad del bloqueo axilar continuo es relativamente desconocida26. Bergman y col63 en una revisión retrospectiva de 405 catéteres axilares registraron 4 casos de complicaciones neurológicas (neuropraxia), de los cuales en 2 de ellos la etiología de la lesión nerviosa no se relacionó con la técnica anestésica. Además, se registraron dos casos de toxicidad neurológica del sistema nervioso central por anestésico local, que se manifestaron con síntomas precomiciales que no progresaron a convulsiones generalizadas ni a cardiotoxicidad. También se comunicó un caso de fragmentación del catéter, quedando éste retenido y un caso de infección en el punto de entrada del catéter en la axila. Grant y col64 publicaron un estudio en el que incluyeron 228 pacientes a quienes se les colocó un catéter para tratamiento del dolor postoperatorio durante 24 horas tras cirugía mayor ambulatoria. La localización más frecuente, en general, del catéter fue a nivel interescalénico, mientras que la localización más frecuente en la extremidad inferior fue a nivel del plexo lumbar posterior y ciático. No registraron ningún caso de complicación aguda o efecto adverso neurológico relacionado con el catéter en las primeras 24 horas ni 7 días después de su colocación. Borgeat y col12 pusieron de manifiesto que la colocación de un catéter interescalénico se asocia con una incidencia de complicaciones agudas y crónicas severas del 0,4% y que el hecho de colocar un catéter no incrementa la incidencia de complicaciones. En la extremidad inferior, Cuvillon y col65 valoraron 211 catéteres femorales y registraron cambios neurológicos en un paciente 24 horas después de haber iniciado la perfusión de anestésico local. Los síntomas desaparecieron 3 horas tras la suspensión de la perfusión y los niveles plasmáticos de anestésico local fueron normales. Además, registraron un caso de paresia del nervio femoral (0,4%), sin déficit motor, 6 semanas después de la colocación del catéter, que se resolvió después de un año. Wiegel M y cols66, en un estudio sobre 1398 pacientes sometidos a BNP continuo (interescalénico, femoral y ciático), observaron inflamación en el sitio de inserción del catéter, sin signos de inflamación sistémica, en el 0.6% de los casos, déficit neurológico tras la retirada del catéter en el 0.9% de casos (13 pacientes). En 12 de ellos la sintomatología finalmente se resolvió y en un paciente con síntomas persistentes se diagnosticó un hematoma retroperitoneal secundario a un sangrado por traumatismo directo de la arteria femoral, que requirió tratamiento quirúrgico. Un paciente con un catéter interescalénico presentó una desaturación y otro sufrió una rotura de un catéter ciático tras su retirada a través de la aguja. En general, se concluyó que la incidencia de complicaciones importantes es baja, siendo más frecuentes las complicaciones leves.
¿Puede reducirse la incidencia de complicaciones con el empleo de la ecografía?
Es conocido que durante la realización de un BNP el nervio puede ser penetrado por la aguja, dando lugar a secuelas de diferente severidad, que pueden ir desde cambios no demostrables hasta déficit sensitivo-motor permanente. La experiencia clínica en BNP guiados con ecografía pone de manifiesto que el reconocimiento precoz de una inyección intraneural se realiza observando como el nervio se hincha con la administración de los primeros mililitros de anestésico local1,67. El cese inmediato de la inyección del anestésico y la recolocación de la aguja hacia una posición extraneural se ha relacionado con la ausencia de déficit neurológico postoperatorio. Para una mayor complejidad, se han descrito casos en los que la punción del nervio y una aparente inyección intraneural durante un BNP guiado con ecografía no produce una lesión nerviosa68. Aunque en la actualidad algunos autores defienden que la visualización directa del avance de la aguja, así como del nervio diana pueden disminuir la frecuencia y severidad de las lesiones nerviosas69,70, los resultados preliminares no apoyan esta hipótesis71, probablemente relacionado con el poco impacto de la técnica de localización nerviosa guiada con ecografía sobre algunos factores de riesgo asociados con la lesión nerviosa. Además, en la práctica clínica habitual la visualización simultánea de la aguja y el nervio puede resultar muy dificultosa, no consiguiéndose en el 60% de los casos en manos poco expertas y en el 10% de los casos en manos expertas72.
Neurotoxicidad de los anestésicos locales. Vasoconstrictor.
Todos los anestésicos locales son potencialmente neurotóxicos21. De hecho, es conocido que la administración de anestésicos locales a una concentración elevada, así como su inyección intraneural, especialmente cuando se administra junto con epinefrina, pueden provocar un daño severo del nervio73. La inyección intraneural del anestésico local puede producir una breve parestesia que rápidamente desaparece por la presencia del anestésico en el interior del nervio. En consecuencia, se ha propuesto la realización del test de Raj con 1 ml de suero salino, para no enmascarar la inyección intraneural por la presencia de anestésico local dentro del nervio. La asociación de vasoconstrictor al anestésico local se debería evitar en un BNP en el cual se produjo una parestesia, para evitar los efectos deletéreos de la vasoconstricción sobre los axones posiblemente dañados. El papel crucial de la concentración del anestésico local en el bloqueo nervioso periférico ha sido confirmado por Nakamura y col74. La administración de vasoconstrictor junto al anestésico local puede reducir el flujo sanguíneo del nervio. Se ha demostrado que la epinefrina 1:100.000 reduce el flujo sanguíneo en el nervio un 35%75. La epinefrina a la vez que reduce el flujo sanguíneo en el nervio facilita la penetración del anestésico local en éste. Esta acción dual puede ser beneficiosa en ocasiones, si bien, en determinadas condiciones puede potenciar la neurotoxicidad del anestésico local21.
6. MEDIDAS QUE SE PUEDEN ADOPTAR PARA REDUCIR EL RIESGO DE LESIÓN NERVIOSA TRAS UN BNP
Son diversas las medidas que se pueden adoptar con la finalidad de reducir el riesgo de complicaciones tras un BNP76,77, como pusieron de manifiesto Wikinski y col78, en el año 1999.
Más recientemente, se han publicado en www.nysora.com las recomendaciones de A. Hadzic, del New York School of Regional Anesthesia, para reducir el riesgo de complicaciones relacionadas con la práctica de BNP11:
- Emplear siempre una técnica aséptica.
- Usar agujas aisladas eléctricamente, de bisel corto y de una longitud adecuada para la técnica que se va a realizar, así como un neuroestimulador que funcione correctamente y que detecte una desconexión en el circuito.
- Realizar maniobras de avance y retirada de la aguja de forma lenta.
- Administrar el anestésico local de manera fraccionada (3-5 ml) y lenta, realizando aspiraciones frecuentes, evitando inyecciones forzadas a una elevada presión y velocidad.
- Evitar la aparición de parestesia coincidiendo con la inyección del anestésico local.
- Emplear los anestésicos locales de forma racional, ajustando el volumen, la concentración y la dosis total al paciente y al tipo de cirugía.
- Evitar la realización de BNP en pacientes anestesiados, así como la repetición de un BNP previamente fallido.
Actualmente, se están desarrollando técnicas de imagen para asistir la práctica de BNP e intentar aumentar la tasa de éxitos y reducir la incidencia de complicaciones. La técnica de imagen no invasiva más segura es la ultrasonografía. Los ultrasonidos son más útiles en zonas superficiales, con poca profundidad, donde los nervios están próximos a los vasos sanguíneos. En algunos casos esta técnica se emplea como complemento de la neuroestimulación.
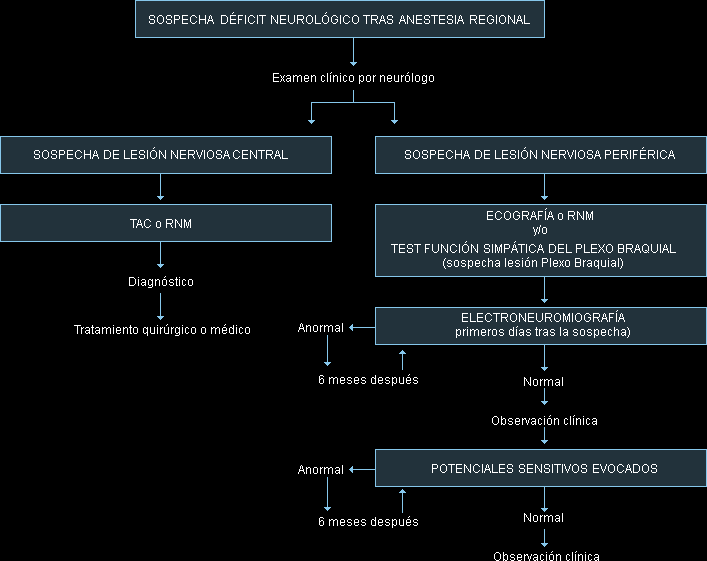
Recientemente, Borgeat13 ha publicado los principios para evitar la lesión nerviosa relacionada con la anestesia regional y el algoritmo (Fig. 1) que los anestesiólogos debemos seguir ante la sospecha de una lesión nerviosa relacionada con la anestesia. Actualmente, algunos autores13,77,79 consideran esencial la elaboración de un protocolo en el que se puedan registrar los nervios estimulados, la intensidad mínima de corriente a la que se observó la respuesta motora, la duración del impulso, así como la aparición de dolor o parestesia durante la realización de la técnica. Además, considera que el registro de estos datos puede ser muy útil en caso de demandas judiciales. Mayfield JB79 destaca la importancia de la enfermería en el cuidado postoperatorio de pacientes sometidos a BNP, adquiriendo relevancia la formación de la enfermería en aspectos como los efectos fisiológicos y preocupaciones del postoperatorio inmediato de la anestesia regional. La enfermería debe ser bien entrenada en el cuidado y protección de las extremidades bloqueadas y en el manejo del dolor postoperatorio. En este sentido, la Fig. 2 es un ejemplo de una hoja de bloqueos que puede facilitar una adecuada documentación de cada caso77.
7. CONCLUSIONES
En los últimos años se han producido importantes avances en el campo de la anestesia regional en general y de los BNP en particular: catéteres estimuladores, aplicación de técnicas de imagen en la realización de BNP, entre otros. Sin embargo, la posibilidad de producir una complicación cuando se realizan estas técnicas, aunque baja, siempre debe ser tenida en cuenta. En este sentido, la aplicación de las recomendaciones proporcionadas por los expertos adquiere gran relevancia. Consideramos un aspecto interesante el seguimiento de los pacientes sometidos a BNP, con la finalidad de diagnosticar precozmente posibles complicaciones relacionadas con estas técnicas y poner en marcha algoritmos y medidas terapéuticas encaminadas a su resolución. Además, dicho seguimiento puede contribuir a un conocimiento más exacto de su verdadera incidencia. Es de esperar que en los próximos años, con la aplicación de las nuevas técnicas y el empleo de nuevo material (agujas, catéteres, neuroestimuladores y ecógrafos de alta resolución), la incidencia de complicaciones relacionadas con la anestesia regional llegue a ser aún más baja. Probablemente, en el aprendizaje de las técnicas de anestesia regional la aplicación de modelos de curva de aprendizaje contribuya a una menor incidencia de complicaciones.
Los puntos clave y algoritmo de actuación ante la sospecha de una complicación durante la realización de un BNP son:
- Aplicar las medidas de prevención recomendadas.
- Realización sistemática y registro detallado de las técnicas.
- Emplear modelos de curvas de aprendizaje durante el período de formación.
- Seguimiento de los pacientes sometidos a anestesia regional.
- Realizar y aplicar protocolos de actuación ante la sospecha de una complicación tras anestesia regional.
A continuación se refleja un algoritmo de actuación ante la sospecha de una complicación tras anestesia regional (Figura 1).
Fig. 1. Algoritmo de actuación ante la sospecha de una complicación tras anestesia regional
Tabla 1. Complicaciones de los bloqueos nerviosos periféricos. Bibliografía.
Tabla 3. Complicaciones de los bloqueos nerviosos periféricos. Bibliografía.
BIE: interescalénico; BAX: axilar; MH: mediohumeral; SC: supraclavicular; F: femoral; CP: ciático proximal; BP: poplíteo; PLP: plexo lumbar posterior; SCC: síndrome compresión cubital; STC: síndrome túnel carpiano; NPB: neuropatía plexo braquial; SDRC: síndrome dolor regional complejo; DNT: déficit neurológico transitorio, DNP: déficit neurológico permanente; C: ciático.
Fig.2. Hoja de bloqueos Nerviosos Periféricos
8. BIBLIOGRAFÍA
- Greensmith JE, Murray WB. Complications of regional anesthesia. Curr Opin Anesthesiol 2006; 19(5): 531-7.
- Borgeat A, Schäppi B, Biasca N, Gerber C. Patient-controlled analgesia alter major shoulder surgery. Anesthesiology 1997; 87(6):1343-7.
- Grossi P, Urmey WF. Peripheral nerve blocks for anaesthesia and postoperative analgesia. Curr Opin Anaesthesiol 2003; 16(5): 493-501.
- Avidan A, Drenger B, Ginosar Y. Peripheral nerve block for ambulatory surgery and postoperative analgesia. Curr Opin Anaesthesiol 2003; 16(6): 567-73.
- Borgeat A, Ekatodramis G, Schenker CA. Postoperative nausea and vomiting in regional anesthesia. Anesthesiology 2003; 98(2): 530-47.
- Capdevila X, Barthelet Y, Biboulet P. Effects of perioperative analgesic technique on the surgical outcome and duration of rehabilitation alter major knee surgery. Anesthesiology 1999;91(1):8-15.
- Borgeat A, Tewes E, Biasca N, Gerber C. Patient-controlled interscalene analgesia with ropivacaine after major shoulder surgery PCIA vs PCA. Br J Anaesth 1998; 81(4): 603-5.
- Auroy Y, Narchi P, Messiah A, Litt L, Rouvier B, Samii K. Serious complications related to regional anesthesia: results of a prospective survey in France. Anesthesiology 1997; 87(3): 479-86.
- Auroy Y, Benhamou D, Bergues L, Ecoffey C, Falissard B, Mercier F et al. Major complications of regional anesthesia in France. Anesthesiology 2002; 97(5):1274-80.
- Fanelli G, Casati A, Garancini P, Torri G. Nerve stimulator and multiple injection technique for upper and lower limb blockade : failure rate, patient acceptance and neurologic complications. Anesth Analg 1999; 88(4): 847-52.
- New York School of Regional Anesthesia. New York. [Actualizado 20 septiembre 2005; citado 15 octubre 2005]. Disponible en http://.nysora.com.
- Borgeat A, Ekatodramis G, Kalberer F, Benz C. Acute and nonacute complications associated with interscalene block and shoulder surgery. Anesthesiology 2001; 95(4): 875-80.
- Borgeat A. Neurologic deficit alter peripheral nerve block: what to do? Minerva Anestesiol 2005; 71(6): 353-5.
- SOSALR ESPAÑA. [Actualizado el viernes, 8 abril 2005; citado 15 octubre 2005]. Disponible en http://.sosalrspain.com.
- Neal JM, Hebl JR, Gerancher JC, Hogan OH. Brachial plexus anesthesia: essentials of our current understanding. Reg Anesth Pain Med 2002; 27(4): 402-28.
- Lynch NM, Cofield RH, Silbert PL, Hermann RC. Neurologic complications after total shoulder arthroplasty. J Shoulder Elbow Surg 1996; 5(1): 53-61.
- Broadman ND 3rd, Cofield RH. Neurologic complications of shoulder surgery. Clin Orthop Relat Res 1999; (368): 44-53.
- Candido KD, Sukhani R, Doty R, Nader A, Kendall MC, Yaghmour E et al. Neurologic sequelae after interscalene brachial plexus block for shoulder upper arm surgery: the associationof patient, anesthesia and surgical factors to the incidence and clinical course. Anesth Analg 2005; 100(5): 1489-95.
- Shah S, Hadzic A, Vloka JD, Cafferty MS, Moucha CS, Santos AC. Neurologic complication after anterior sciatic nerve block. Anesth Analg 2005; 100(5): 1515-7.
- Cheney FW, Domino KB, Caplan RA, Posner KL. Nerve injury associated with anesthesia: a closed claims analysis. Anesthesiology 1999; 90(4): 1062-9.
- Borgeat A, Blumenthal S. Nerve injury and regional anaesthesia. Curr Opin Anaesthesiol 2005;17(5): 417-21.
- Borgeat A, Dullenkopf A, Ekatodramis G, Nagy L. Evaluation of the lateral modified approach for continuous interscalene block after shoulder surgery. Anesthesiology 2003; 99(2): 436-42.
- Selander D. Nerve toxicity of local anaesthetics, local anaesthesia and regional blockade. 1st edition. Amsterdan: Elsevier Science, 1988.
- Selander D, Edshage S, Wolff T. Parasthesiae or no parasthesiae? Nerve lesions after axillary blocks. Acta Anaesth Scand 1979; 23(1): 27-33.
- Hebl JR. Ultrasound guided regional anesthesia and the prevention of neurologic injury. Anesthesiology 2008; 108(2): 186-8.
- Urban MK, Urquhart B. Evaluation of brachial plexus anesthesia for upper extremity surgery. Reg Anesth 1994; 19(3): 175-82.
- Feindel W, Stratford J. The role of the cubital tunnel in tardy ulnar palsy. Can J Surg 1958; 1(4): 287-300.
- Walker SM, Cousins MJ. Complex regional pain syndromes: including reflex sympathetic dystrophy and causalgia. Anesth Intens Care 1997; 25(2):113-25.
- Makitie J, Teravainen H. Peripheral nerve injury and recovery after temporary ischemia. Acta Neuropathol 1977; 37(1): 55-63.
- Ochoa J, Fowler TJ, Gilliatt RW. Anatomical changes in peripheral nerves compressed by a pneumatic tourniquet. J Anat 1972; 113(3): 433-55.
- Rydevik BL, Lundborg G. Permeability of intraneural microvesels and perineurium following acute, graded experimental nerve compression. Scand J Plast Reconstr Surg 1977; 11(3): 179-87.
- Brown DL, Ramson DM, Hall JA, Leicht CH, Schroeder DR, Offord KP. Regional anesthesia and local anesthetic induced systemic toxicity: seizure fequency and accompanying cardiovascular changes. Anesth Analg 1995; 81(2): 321-8.
- Urmey W, Talts K, Sharrock N. One hundred percent incidence of hemidiaphragmatic paresis associated with interscalene brachial plexus anesthesia as diagnosed by ultrasonography. Anesth Analg 1991; 72(4): 498-503.
- Pham-Dang C, Gunst JP, Gouin F, Poirier P, Touchais S, Meunier JF et al. A novel supraclavicular approach to brachial plexus block. Anesth Analg 1997; 85(1):111-6.
- Vloka JD, Hadzic A, Thys DM. Peripheral nerve stimulators for regional anesthesia can generate excessive voltage output with poor ground conection. Anesth Analg 2000; 91(5): 1306-13.
- Pitcher CE, Raj PP, Ford DJ. The use of peripheral nerve stimulators for regional anesthesia: a review of experimental characteristics. Reg Anesth 1985; 10(2): 49-58.
- Neal JM. How close is close enough? Defining the paresthesia chad. Reg Anesth Pain Med 2001; 26(2): 97-9.
- Franco CD, Domashevich V, Voronov G, Rafizad A, Jelev TJ. The supraclavicular block with a nerve stimulator: to decrease or not to decrease. That is the question. Anesth Analg 2004; 98(4):1167-71.
- Heid FM, Jage J, Guth M, Bauwe N, Brambrink M. Efficacy of vertical infraclavicular plexus block versus modified axillary plexus block: a prospective, randomized, observer blinded study. Acta Anaesthesiol Scand 2005; 49(5): 677-82.
- Rodríguez J, Taboada-Muñiz M, Bárcena M, Álvarez J. Median versus musculocutaneous nerve response with single injection infraclavicular corocoid block. Reg Anesth Pain Med 2004; 29(6): 534-8.
- Enneking FK, Chan V, Greger J, Hadzic A, Lang SA, Horlocker TT. Lower extremity peripheral nerve blockade: essentials of our current understanding. Reg Anesth Pain Med 2004; 30(1): 4-35.
- Reina MA, López A, Da Andrés JA, Machés F. Posibilidad de lesiones nerviosas relacionadas con los bloqueos nerviosos periféricos. Un estudio en nervio ciático humano con diferentes agujas. Rev Esp Anestesiol Reanim 2003; 50(6): 274-83.
- Urmey WF. Interscalene block: the truth about twitches. Reg Anesth Pain Med 2000; 25(4): 340-2.
- Capdevila X, Choquet O. Is low current search a risk factor in peripheral nerve localization? Anesthesiology 2006; 104(6):1348.
- Lavoie J, Martin R, Tetrault JP, Cote DJ, Colas MJ. Axillary plexus block using a peripheral nerve stimulator: single or multiple injections. Can J Anaesth 1992; 39(6): 583-6.
- Baranowski AP, Pither CE. A comparison of three methods of axillary plexus anaesthesia. Anaesthesia 1990; 45(5): 362-5.
- Selander D, Sjostrand J. Longitudinal spread of intraneurally injected local anesthetics. An experimental study of the initial neural distribution following intraneural injections. Acta Anaesthesiol Scand 1978; 22(6): 622-34.
- Selander D. Peripheral nerve injury after regional anesthesia. En Finucane BT Editors. Complications of regional anesthesia. Philadelphia: Churchill Livingstone; 1999.p. 105-115.
- Hadzic A, Dilberovic F, Shah S. Combination of intraneural injection and high injection pressure leads to fascicular injury and neurologic deficit in dogs. Reg Anesth Pain Med 2004; 29(5): 417-23.
- Claudio R, Hadzic A, Shih H. Injection pressures by anaesthesiologist during simulated peripheral nerve block. Reg Anesth Pain Med 2004; 29(3): 201-5.
- Selander D, Dhuner KG, Lundborg G. Peripheral nerve injury due to injection needles used for regional anesthesia. An experimental studyof the acute effects of needle point trauma. Acta Anaesthesiol Scand 1977; 21(3):182-8.
- Rice AS, Mc Mahon SB. Peripheral nerve injury caused by injection needles used in regional anesthesia: influence of bevel configuration. Studied in a rat model. Br J Anaesth 1992; 69(5): 433-8.
- Marhofer P, Greher M, Kapral S. Ultrasound guidance in regional anesthesia. Br J Anaesth 2005; 94(1): 7-17.
- Neal JM, Hebl JR, Gerancher JC, Hogan QH. Brachial plexus anesthesia: essential of our current understanding. Reg Anesth Pain Med 2002; 27(2):402-28.
- Ilfeld BM, Morey TE, Enneking FK. Continuous infraclavicular brachial plexus block for postoperative pain control at home: a randomized, double-blinded, placebo controlled study. Anesthesiology 2002; 96(6):1297-1304.
- Ilfeld BM, Morey TE, Wang RD, Enneking FK. Continuous popliteal sciatic nerve block for postoperative pain control: a randomized, double-blinded, placebo controlled study. Anesthesiology 2002; 97(4): 959-65.
- Di Benedetto P, Casati A, Bertini L. Continuous subgluteus sciatic nerve block after orthopaedic foot and ankle surgery: a comparison of two infusion techniques. Reg Anesth Pain Med 2002; 27(2): 168-72.
- Martínez Navas A, Vázquez Gutiérrez T, Echevarría Moreno M. Bloqueo poplíteo continuo con ropivacaína mediante catéter estimulante para analgesia postoperatoria tras cirugía del pie. Rev Esp Anestesiol Reanim 2003; 50(4): 188-191.
- Ortiz de la Tabla González R, Vázquez Gutiérrez T, Martínez Navas A, Echevarría Moreno M. Bloqueo interesternocleidomastoideo continuo y bloqueo mediohumeral para anestesia de fractura de hombro y antebrazo contralateral. Rev Esp Anestesiol Reanim 2005; 52(3):181-2.
- Martínez Navas A, Vázquez Gutiérrez T, Echevarría Moreno M. Continuous lateral popliteal block with stimulating catheters. Acta Anaesthesiol Scand 2005; 49(2): 261-3.
- Martínez Navas A, Vázquez Gutiérrez T, Echevarría Moreno M. Continuous peripheral nerve blockade in lower extremity surgery. Acta Anaesthesiol Scand 2005; 49(8):1048-55.
- Bergman BD, Hebe JR, Kent J, Horlocker TT. Neurologic complications of 405 consecutive continuous axillary catheters. Anesth Analg 2003; 96(1): 247-52.
- Grant SA, Nielsen KG, Greengrass RA, Steele SM, Klein SM. Continuous peripheral nerve block for ambulatory surgery. Reg Anesth Pain Med 2001; 26(3): 209-214.
- Cuvillon P, Ripart J, Lalourcey L, Veyrat E, L Hermite J, Boisson C et al. The continuous femoral nerve block catheter for postoperative analgesia: bacterial colonization, infectious rate and adverse effects. Anesth Analg 2001; 93(4):1045-49.
- Wiegel M, Gottschaldt U, Hennebach R, Hirschberg T, Reske A. Complications and adverse effects associated with peripheral nerve blocks in orthoperdic patients. Anesth Analg 2007;104(6): 1578-82.
- Brull R, Chan VW, McCartney CJL, Perlas A, Xu D. Ultrasound detects intraneural injection. Anesthesiology 2007; 106(6): 1244.
- Bigeleisen PE. Nerve puncture and apparent intraneural injection during ultrasound-guided axillary block does not invariably result in neurologic injury. Anesthesiology 2006; 105(4): 779-83.
- Loubert C, William SR, Hélie F, Arcand G. Complications during ultrasound guided regional block: accidental intravascular injection of local anesthestic. Anesthesiology 2008; 108(4): 759-60.
- Hadzic A, Sala-Blanch X, Xu D. Ultrasound guidance may reduce but not eliminate complications of peripheral nerve blocks. Anesthesiology 2008; 108(4): 557-8.
- Horlocker TT, Wedel DJ. Ultrasound-guided regional anesthesia: in search of the holy grail. Anesth Analg 2007; 104(5):1009-11.
- Sites BD, Spence BC, Gallagher JD, Wiley CW, Bertrand ML, Blike GT. Characterizing novice behaviour associated with learning ultrasound-guided peripheral regional anesthesia. Reg Anesth Pain Med 2007; 32(2): 107-15.
- Selander D. Neurotoxicity of local anesthetics: animal data. Reg Anesth 1993; 18(6): 461-8.
- Nakamura T, Popitz-Bergez F, Birknes J. Strichartz GR. The critical role of concentration for lidocaine block of peripheral nerve in vivo: studies of function and drug uptake in the rat. Anesthesiology 2003; 99(5): 1189-97.
- Partridge BL. The effect of local anesthetics and epinephrine on rat sciatic nerve blood flow. Anesthesiology 1991; 75(2): 243-50.
- Berg AP, Rosenquist RW. Complications of peripheral nerve blocks. Tech Reg Anesth Pain Management 1007; 11(1): 133-140.
- Martínez Navas A. Complicaciones de los bloqueos nerviosos periféricos. Rev Esp Anestesiol Reanim 2006; 53(4): 237-48.
- Wikinski JA, Bollini C. Complicaciones neurológicas de la anestesia regional periférica y central. Buenos Aires, Panamericana. 1999.
- Mayfield JB. Diagnosis and management of peripheral nerve block complications. Int Anesthesiol Clin 2005 ; 43(3): 119-26.