Dolor neuropático
Dr. Jesús Estrada Fernández - Servicio de anestesia y reanimación. Unidad del dolor. Hospital Universitario de Getafe.
A. DEFINICIÓN, EPIDEMIOLOGÍA Y FISIOPATOLOGÍA
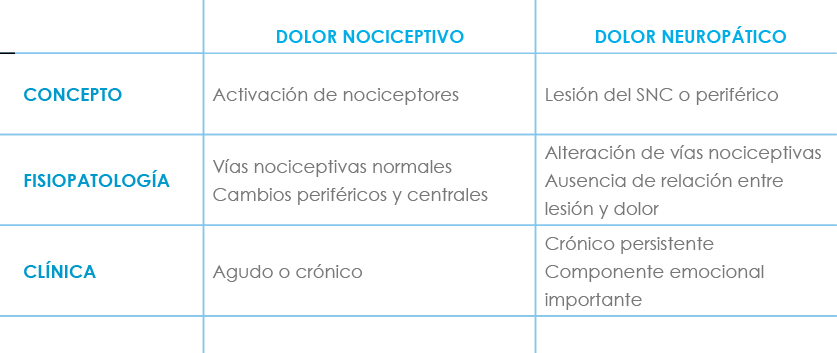
La IASP (Asociación Internacional para el Estudio del Dolor), define el dolor neuropático como “el causado por una lesión o disfunción primaria del sistema nervioso central o periférico”, (Hansson et al)(1) que transmiten señales dolorosas de estímulos que habitualmente no lo son o incluso sin la presencia de ningún estímulo. Se le ha denominado también como “dolor anormal o patológico” por sus características, diferentes del llamado “dolor normal” o nociceptivo, que es aquel en el que la respuesta está directamente relacionada con la intensidad del estímulo aplicado.
Tabla I: Diferencias entre dolor nociceptivo y neuropático
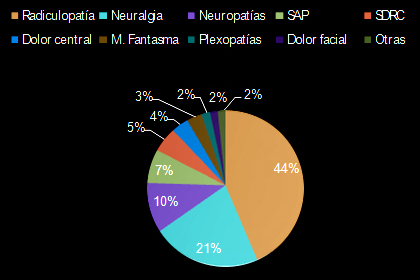
La repercusión sociolaboral y familiar del dolor es abrumadora y aunque no se dispone de datos estadísticos minuciosos a escala nacional, el Profesor Bonica afirma que “casi un tercio de la población de los países desarrollados padece dolor crónico y de éstos, entre la mitad y las dos terceras partes están total o parcialmente incapacitados durante periodos de tiempo variables, e incluso de forma permanente”. La encuesta “Pain in Europe” realizada en los años 2002 y 2003 en 16 países europeos, demostró que, en España, el dolor crónico afecta al 11% de la población. De este global, el 24% cumplieron criterios de dolor neuropático (más de un millón de españoles) representando entre el 20 y el 40% de las consultas en las Unidades del Dolor de los Hospitales de nuestro medio y el 34% de los pacientes oncológicos lo presentan(2) (Sinnot et al.). En cuanto a la prevalencia de sus distintos subtipos, la observamos en la Figura 1.
Figura 1. Distribución dolor neuropático
En cuanto a su fisiopatología, se supone que entran en juego fenómenos de hiperexcitabilidad y plasticidad neuronal, tanto a escala periférica como central, en la médula espinal, corteza somatosensorial y vías inhibitorias descendentes. La lesión nerviosa periférica origina una degeneración walleriana del axón, distal a la lesión, y crecimiento secundario de los axones proximales (neuroma), formado a partir de fibras amielínicas C y mielinizadas A (Aß y Ad). Las parestesias y disestesias son transmitidas por fibras Aß. Las fibras C son las responsables de la quemazón, hiperalgesia y alodinia. Tras el daño nervioso se produce un aumento de la excitabilidad de las fibras lesionadas y adyacentes (hiperexcitabilidad), que induce hipersensibilización central y fenómenos de plasticidad, mediados por canales iónicos de sodio. En la médula espinal se produce una reorganización de las neuronas del asta posterior, mediada por ciertos neurotransmisores, como el Glutamato y la sustancia P, ligandos de receptores AMPA/kainato, metabotrópicos y NMDA (N-metil D-aspartato), que incorporan un canal de calcio. De esta manera se produce el fenómeno “wind up”, que implica reclutamiento neuronal. Todo ello lleva a cambios definitivos en los receptores que transmiten los impulsos dolorosos, de modo que neuronas que transmiten impulsos “específicos” se convierten en neuronas de amplio rango dinámico (WDR), transmisoras de impulsos de cualquier calidad.
B. TERMINOLOGÍA Y CLASIFICACIÓN
A. Respuestas espontáneas
- Dolor: Experiencia sensitiva y emocional desagradable asociada a daño tisular real o potencial.
- Dolor crónico: el que excede el periodo normal de curación (3-6 meses).
- Alodinia: dolor provocado por estímulos que normalmente no son dolorosos.
- Hiperalgesia: exceso de respuesta dolorosa ante estímulos que ya lo son.
- Hiperestesia: respuesta exagerada a un estímulo térmico o táctil.
- Hiperpatía: persistencia de la sensación dolorosa tras cesar el estímulo.
- Analgesia: ausencia de percepción del dolor tras un estímulo nocivo.
- Hipoalgesia: disminución de la sensación dolorosa tras la aplicación de un estímulo nocivo.
- Anestesia: ausencia de percepción sensorial ante cualquier estímulo físico, tanto de alto como de bajo umbral.
- Hipoestesia: disminución de la percepción sensorial.
- WDR: neuronas de amplio rango dinámico, que responden a diferentes tipos de estímulos.
- Windup: reclutamiento de neuronas de amplio rango dinámico.
B. Respuestas espontáneas o evocadas
- Parestesia: cualquier sensación anormal, espontánea o evocada, tras un estímulo no desagradable.
- Disestesia: sensación desagradable ante un estímulo normal o, incluso, sin ningún estímulo.
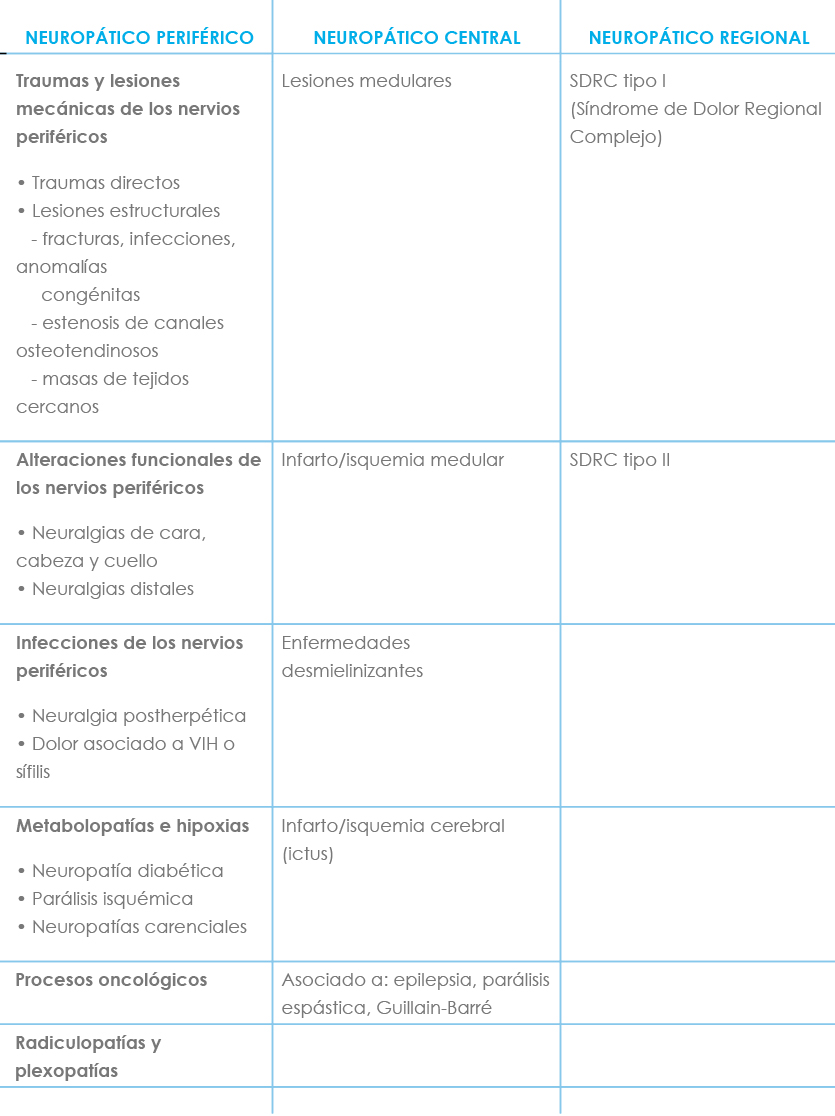
En la Tabla II se expone la clasificación del DN más extensamente aceptada.
Tabla II: Clasificación dolor neuropático
Creemos que la tabla anterior recoge con mayor sentido práctico la realidad cotidiana. No obstante debe conocerse que la IASP creó una clasificación que tiene valor como herramienta para la codificación por Axis. Establece 33 grupos según criterios de localización a los que enumera según código romano y que por su interés incluimos a continuación:
1. Dolor neuropático periférico.
1.1. Relativamente generalizado (Grupo I)
1.2. Localizado
1.2.1. Cabeza y cara (Grupo II)
1.2.2. Columna
1.2.2.1. Cervical (Grupo IX)
1.2.2.2. Dorsal (Grupo X)
1.2.2.3. Lumbar (grupo XXVI)
1.2.2.4. 1Sacrocoxígeo (Grupos XXVII y XXVIII)
1.2.3. Miembros superiores (Grupos XI y XII)
1.2.4. Tórax (Grupo XVII)
1.2.5. Abdomen (Grupos XX y XXI)
1.2.6. Recto y periné (Grupo XXV)
1.2.7. Miembros inferiores (Grupo XXXI)
2. Dolor neuropático central
2.1. Relativamente generalizado (Grupo I)
2.2. Localizado
2.2.1. Cabeza y cara (Grupo I)
2.2.2. Columna
1.1.1.1. Cervical (Grupo IX)
1.1.1.2. Dorsal (Grupo X)
1.1.1.3. Lumbar (Grupo XXVI)
2.2.3. Miembros superiores (Grupo I)
2.2.4. Tórax (Grupo XVII)
2.2.5. Abdomen (Grupo XX)
2.2.6. Miembros inferiores (Grupo I)
2.3. Generalizado (Grupo I)
3. Dolor simpático regional. (Grupo I)
C. GENÉTICA
No pretendemos aquí exponer exhaustivamente las enormes posibilidades que se abren ante los avances en el campo de la genética aplicada al tratamiento del dolor. Solo pretendemos comentar algunos conceptos claves para su comprensión. Una compleja red de proteínas estructurales y neurotransmisores se encargan de regular la señal dolorosa. Dichas proteínas están codificadas por genes concluyéndose que el genoma humano, localizado en el DNA, es el encargado de procesar la transmisión del dolor. La expresión de los genes (más que la propia dotación genética) y su polimorfismo explican las diferencias interindividuales en términos de susceptibilidad a las enfermedades o la respuesta a diversos tratamientos(3) (MacFarlane et al).
No todos los genes se expresan, definiéndose como “expresión” al mecanismo por el que la información contenida en el ADN se convierte en ARNm, que da lugar a la síntesis de una proteína. La expresión génica permite a la célula adaptarse y responder a los estímulos procedentes de otras células o del exterior. Es posible en el momento actual definir la variación genómica que contribuye a la susceptibilidad de la enfermedad o a la respuesta/resistencia al tratamiento. Estas variaciones pueden resultar de gran utilidad para identificar dianas terapéuticas (Farmacogenómica) o predecir el grado de respuesta farmacológica a un tratamiento (Farmacogenética).
Los estudios genéticos relacionados con el dolor han confirmado la presencia de grandes diferencias interindividuales en la sensibilidad y tolerancia a la sensación dolorosa. Hoy sabemos que estas diferencias fenotípicas son el reflejo de diferencias genéticas(4) (Chapman et al). La caracterización de estos genes se lleva a cabo generalmente mediante dos aproximaciones complementarias:
1. Estudios de ligamiento genético: han permitido en las últimas dos décadas caracterizar algunos genes implicados directamente en trastornos de la percepción dolorosa.
- Síndrome de insensibilidad congénita al dolor con anhidrosis (CIPA): el factor de crecimiento nervioso (NGF) es el responsable del dolor tras el daño tisular. Su receptor está codificado por el gen TRKA. Hasta el momento se han descrito 37 mutaciones y 22 polimorfismos diferentes en familias afectadas(5) (Indo).
- Migraña hemipléjica familiar (FHM): achacable a 4 mutaciones del gen que codifica la subunidad a del canal de calcio (CACNL1A4).
2. Estudios de asociación genética: analizan la posible relación entre los polimorfismos genéticos y diferentes entidades nosológicas. La mayoría de ellos se relacionan con la migraña. (Los genes candidatos a este tipo de estudios son los responsables de la síntesis, transporte y fijación de las proteínas implicadas en las diferentes etapas de la transmisión de la señal dolorosa: Son muy numerosas resultando las más conocidas las citoquinas (factor de necrosis tumoral alfa o TNFa, interleuquinas IL6 e IL8, glutamato, cicloxigenasa 2 o COX2), el receptor vaniloide de la capsaicina (VR1), el sistema opioide, el catecolaminérgico, el serotonérgico, el gabaérgico con el GABA como principal neurotransmisor inhibidor del SNC, la proteína DREAM y la sintetasa del óxido nítrico o NOS.
Además de la importancia que tiene el estudio de los genes que codifican proteínas implicadas en la transmisión de la sensación dolorosa, los estudios de genética permiten definir genotipos que puedan explicar la diferente respuesta al tratamiento analgésico. Los realizados en el gen que codifica la enzima citocromo P 450, encargada de convertir la codeína en morfina(6) (Mattson) revelaron la existencia de dos tipos de individuos. Los denominados “metabolizadores lentos” (PM) que se benefician poco de la administración de codeína y los “metabolizadores rápidos” (EM).
Existiría un “perfil genético” que hace a ciertos sujetos propensos al dolor crónico, bien por alteración de la sensibilidad al dolor o por la alteración de la respuesta neurológica al estímulo nociceptivo o por alteración de la susceptibilidad al dolor (personalidad), que los haría particularmente frágiles. No se ha podido demostrar, no obstante, la presencia de genes específicos vinculados al dolor inflamatorio o neuropático, aunque sí la posible relación de algunos de ellos, como se indica a continuación:
Tabla III. Posible relación entre distintos genes y el dolor neuropático
Para una exposición más detallada remitimos al lector al Capítulo “Genética y dolor neuropático”, editado por la SED en el 2006 (nº 5), con el título “Dolor Neuropático”. No queremos concluir esta Sección sin hacer referencia de nuevo a la creciente importancia de la farmacogenómica, que permitirá en un futuro no lejano la aplicación de fármacos “a la carta”, es decir, a la medida de cada paciente y específicos para cada enfermedad, una vez conocido el genoma individual y la potencial respuesta de ese paciente a los fármacos, previniendo además la aparición de efectos adversos y reduciendo costes.
D. SITUACIONES QUE PUEDEN PROVOCARLO
- Lesión neural de cualquier causa
- Incisión quirúrgica mínima (neuroma)
- Fracturas (con yeso o quirúrgicas)
- Causas tóxicas o infecciosas (herpes)
- Causas metabólicas (diabetes)
- Amputación de miembros
- ACVA (Síndrome talámico)
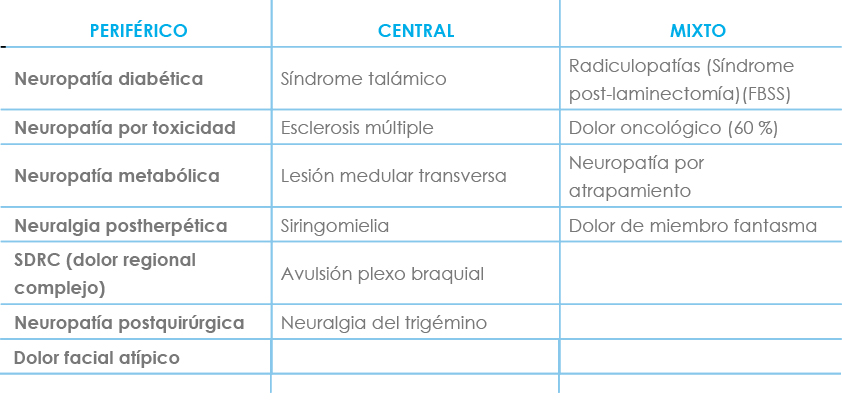
E. SÍNDROMES MÁS FRECUENTES (TABLA IV)
Tabla IV. Síndromes de dolor neuropático frecuentes
A continuación se describen brevemente las características fundamentales de los más frecuentes.
NEURALGIA POSTHERPÉTICA
El prototipo humano del dolor neuropático crónico. Se considera su diagnóstico, al menos tres meses después de la aparición de las vesículas. Su prevalencia oscila entre un 2-35 % de los pacientes con herpes zóster (HZ) pero en los mayores de 60 años alcanza un 50%. El dolor presenta características variables, desde continuo y lancinante hasta paroxístico con parestesias y – sobre todo – alodinia dinámica, provocada por roce o deslizamiento suave en la zona dérmica afectada. La evolución es larga y puede persistir el dolor durante años, resultando en ocasiones incapacitante.
NEUROPATÍA DIABÉTICA DOLOROSA
Una de las complicaciones más temidas de la diabetes mellitus. El dolor se debe a la alteración de los nervios periféricos, que sufren la isquemia crítica de los vasa nervorum(7). Casi exclusivamente localizado en las zonas distales (manos y pies), provocando una severa incapacidad e importante deterioro de la calidad de vida. Afecta a un 50% de los diabéticos pero sólo un 11 % de ellos sufrirá DN(8).
NEURALGIA DEL TRIGÉMINO
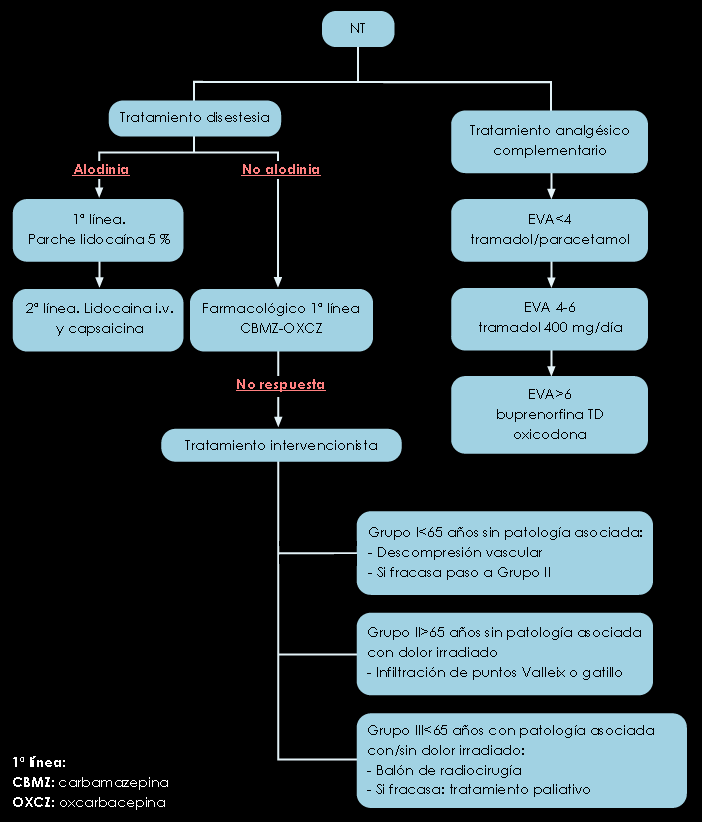
Dolor paroxístico, lancinante y de breve duración (5-20 segundos), muy frecuentemente unilateral y localizado en el territorio de una o más ramas del V par craneal. Con mayor frecuencia afecta a las ramas II (maxilar) y III (mandibular), pero puede extenderse a cualquiera de ellas. El dolor puede ser espontáneo o provocado por estímulos externos sobre determinadas zonas gatillo (tacto, viento, masticación). No se acompaña de déficit neurológico en la neuralgia esencial o idiopática y por tanto, la presencia de alguna anomalía sensomotora debe alertar sobre su etiología, buscando patología orgánica subyacente. Es más frecuente en mujeres y en la 2ª o 3ª edad. La causa más frecuente es la compresión vascular de la raíz del nervio en su punto de entrada en la protuberancia (80-90% de los casos) y fue descrita por vez primera por Janetta en 1967(9). El patrón temporal es recurrente con fases sintomáticas de meses o años de duración alternando con remisiones de duración variable. El tratamiento farmacológico resulta completamente eficaz en algunas ocasiones y con frecuencia es preciso recurrir a procedimientos intervencionistas (microcompresión vascular con balón, radiofrecuencia del ganglio de Gasser).
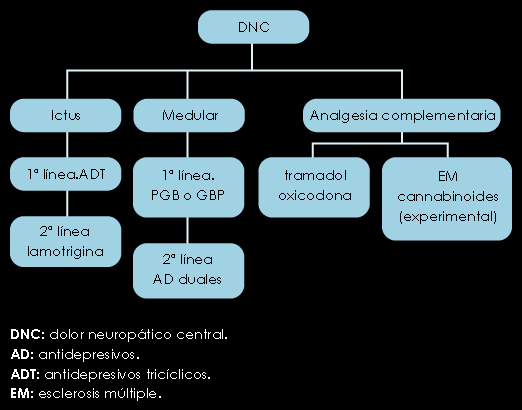
DOLOR NEUROPÁTICO CENTRAL
La IASP (International Association for Study of Pain) lo define como el causado por una lesión primaria o disfunción en la médula espinal, tallo cerebral, tálamo, córtex y estructuras supratalámicas. No hay ninguna correlación entre la extensión de la lesión y la severidad del dolor, que se asocia frecuentemente a sensibilidad anormal y suele desarrollarse tardíamente tras la lesión. El dolor medular puede ser uni o bilateral y en este último caso, resulta difuso y con afectación perineal y dolor visceral insoportable. Si la lesión es cervicotorácica, la respuesta simpática puede provocar estrés y fatiga por un simple movimiento. El dolor talámico es habitualmente unilateral, con opresión y calambres musculares, componente neuropático intenso y además dolor visceral paroxístico frecuente (vesical). El dolor de la esclerosis múltiple se localiza en los miembros inferiores y es continuo con crisis paroxísticas.
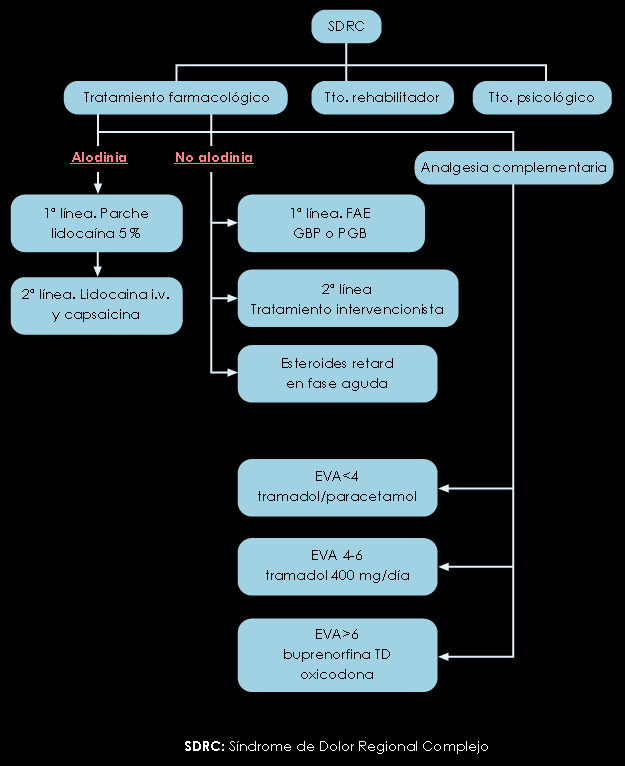
DOLOR NEUROPÁTICO SIMPÁTICO O DOLOR REGIONAL COMPLEJO
Entidad clínica de difícil diagnóstico descrita por primera vez por Silas Weir-Mitchell en 1864. Ha recibido muy distintos nombres a lo largo de los tiempos (causalgia, distrofia simpático-refleja, algodistrofia, atrofia de Sudek) hasta la nomenclatura actual, aprobada por la IASP en 1994(10). Se define entonces como” un síndrome complejo, fundamentalmente doloroso, neuropático, crónico, desproporcionado a la lesión traumática tisular o neurológica que lo origina e incluye una gama de signos y síntomas variados y de tipo neurovegetativo”. Se delimitan el Tipo I, en ausencia de daño neurológico (la antigua Distrofia Simpático-Refleja) y el Tipo II, cuando existe daño neurológico (antigua Causalgia). Su fisiopatología es confusa pero en la mayor parte de las situaciones el paciente reconoce un traumatismo previo. Clínicamente se caracteriza por la presencia de 2 situaciones: una aguda con toda la sintomatología inherente a una inflamación regional y otra crónica, en la que predomina claramente el componente neuropático. Aunque tradicionalmente se ha implicado al Sistema Nervioso Simpático (SNS) en su perpetuación y desarrollo, por el hecho de que algunos pacientes mejoraban tras uno o varios bloqueos simpáticos del nivel afectado, no está clara su participación. Ante un paciente con esta sospecha es preciso:
- Realizar una búsqueda exhaustiva de la existencia de una lesión nerviosa.
- Evitar – si es posible – los procedimientos intervencionistas, en especial aquellos sobre los que no exista evidencia clínica demostrada.
- No descartar nunca un posible origen psicológico.
En cuanto a sus 2 formas crónicas pueden resumirse como sigue:
I. SDRC tipo I
- Presencia previa de estímulo nocivo o inmovilización de un miembro.
- Dolor continuo, alodinia e hiperalgesia desproporcionada a la lesión.
- Evidencia en algún momento de la evolución de edema, cambios en el flujo sanguíneo cutáneo o actividad sudomotora anómala en el área afectada.
- Exclusión diagnóstica en presencia de otras causas que lo justifiquen.
II. SDRC tipo II
- Dolor continuo, alodinia e hiperalgesia tras una lesión en un nervio, no necesariamente limitados al territorio del nervio lesionado.
- Evidencia en algún momento de la evolución de edema, cambios en el flujo sanguíneo cutáneo o actividad sudomotora anómala en el área afectada.
- Exclusión diagnóstica en presencia de otras causas que lo justifiquen.
Más adelante se comentarán las opciones de tratamiento, que son básicamente las utilizadas en los 3 síndromes más estudiados sobre dolor neuropático (NPH; NDD y NT).
F. SINTOMATOLOGÍA Y EXPLORACIÓN
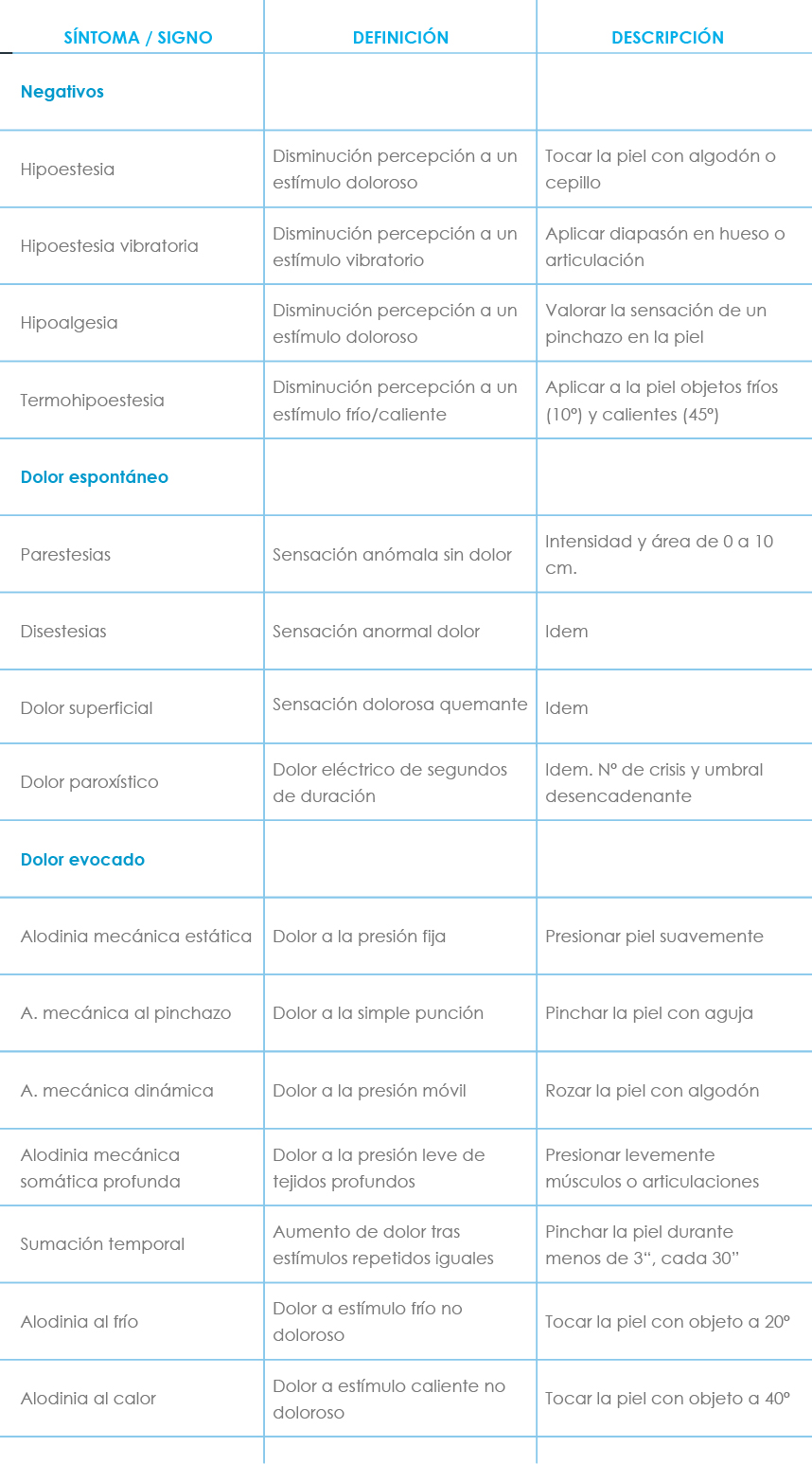
Como en cualquier lesión del sistema nervioso pueden estar presentes síntomas – más que signos – positivos (hiper o disfunción) y negativos (hipofunción o ausencia completa). Se consideran POSITIVOS en el dolor neuropático las disestesias y parestesias - provocadas por la lesión de las fibras Aß táctiles - , el dolor espontáneo y el evocado. Serían NEGATIVOS la hipoestesia y la analgesia. Clínicamente debemos diferenciar entre síntomas espontáneos (dolor lancinante o paroxístico, dolor urente o quemante – que se debe a le lesión de las fibras C y a desinhibición gabaérgica - , las parestesias y las disestesias) y los que se producen como respuesta a un estímulo o evocados (hiperalgesia, hiperpatía y alodinia). El dolor espontáneo puede ser continuo o paroxístico, que el paciente describe como ráfaga o disparos, quemante, eléctrico, calambre, etc., y que se debe a descargas ectópicas provocadas por la lesión de las fibras Ad. En la tabla V(11) se exponen resumidas todas las características señaladas anteriormente y su valoración descriptiva.
Tabla V. Síntomas en el dolor neuropático(11)
G. PRUEBAS DIAGNÓSTICAS
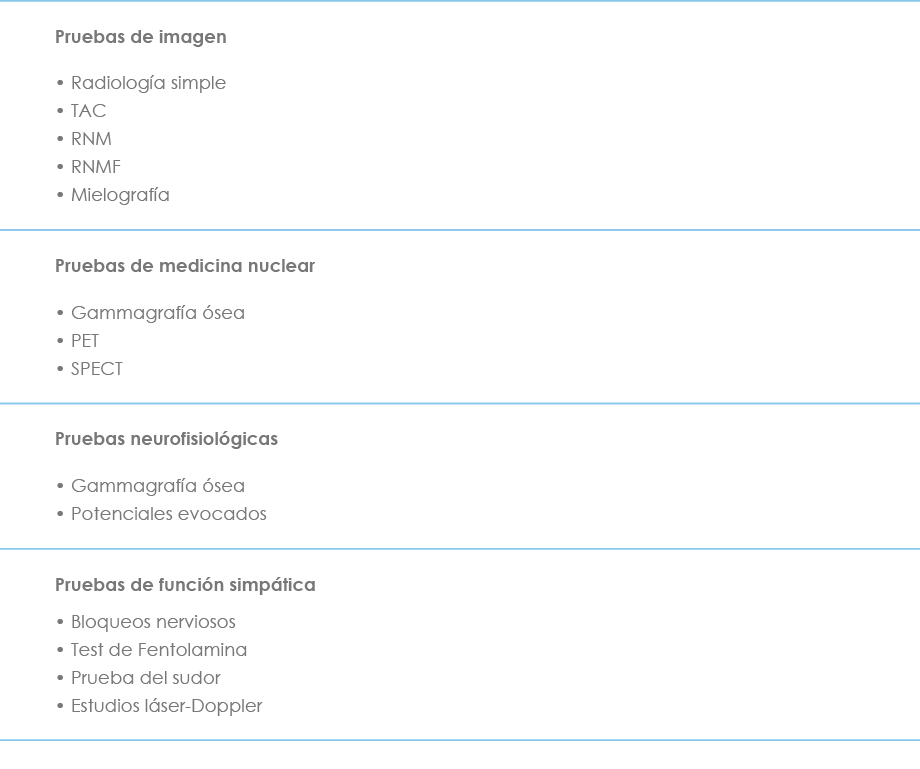
Una de las características del dolor neuropático es la imposibilidad de completar el diagnóstico a través de las pruebas convencionales, de manera que se basa en la clínica y en una exhaustiva anamnesis. La mayoría de las pruebas diagnósticas son neurofisiológicas. El resto son pruebas de imagen, sobre todo las más modernas, como la PET (tomografía por emisión de positrones), la SPECT (tomografía computerizada por emisión de fotón único), la PET-TAC y la RMNF (resonancia magnética nuclear funcional). No es la intención de esta obra profundizar en las características e indicaciones de cada una de ellas. En la tabla VI se resumen las más utilizadas.
Tabla VI. Pruebas diagnósticas en el dolor neuropático
H. ESCALAS DE VALORACIÓN(11)
La necesidad de utilizar escalas específicas para la valoración del dolor neuropático queda explicada porque es imprescindible discernir la variedad del dolor y detectar los diferentes síntomas y signos, espontáneos o evocados, positivos o negativos y decidir la indicación terapéutica más adecuada en cada caso. Existen un buen número de ellas, recomendando utilizar las más sencillas. Deben aplicarse siempre de forma complementaria a cualquier otra escala de las que se empleen para la valoración del dolor nociceptivo (EVA o VAS; EVS; Escala numérica). A continuación se exponen las más conocidas:
Escala Lanss (Leeds Assessment of Neuropathic Symptoms)
- La primera utilizada para diferenciar dolor nociceptivo del neuropático (DN). Requiere exploración de posible disfunción sensorial.
- 7 preguntas puntuables. Se considera DN por encima de 12 puntos.
- Sensibilidad y especificidad del 80-90 %.
- Validada en español en 2006.
Escala DN4 (Douleur Neuropathique en 4 questions)
- 7 preguntas sobre síntomas y tres relacionadas con la exploración.
- Más de 4 sugiere DN.
- Similar a la de Lanss en cuanto a especificidad y sensibilidad.
- Validada en español e 2007.
Escala ID-Pain
- 5 descriptores. No requiere exploración.
- Sensibilidad y especificidad mayor del 80 %.
- Validada al español.
Escala NPQ (Neuropathic Pain Questionnaire)
- 12 descriptores. No requiere exploración.
- Sensibilidad y especificidad del 65-75%.
- No validada al español.
Escala Pain DETECT
- 9 descriptores. No requiere exploración.
- Más de 12 puntos sugiere DN.
- La más recientemente publicada.
- Validada solo en alemán.
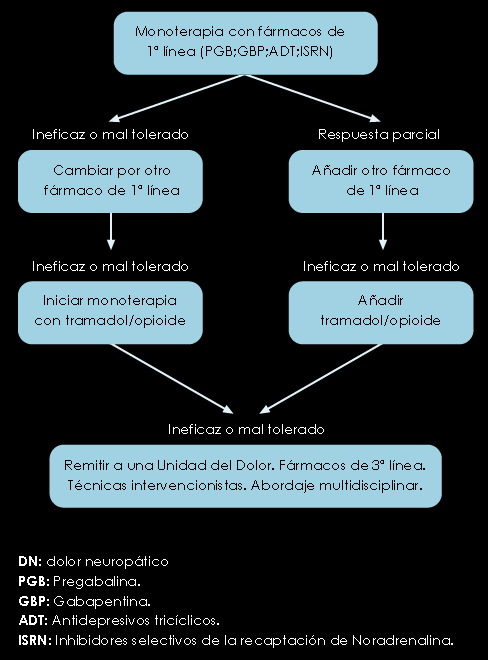
I. ALGORITMOS DE TRATAMIENTO
Figura 2. Algoritmo de tratamiento farmacológico DN
En una muy reciente publicación, González Escalada y colaboradores(12), revisan los tratamientos farmacológicos basados en la evidencia clínica disponible y elaboran algunos algoritmos. Se han revisado estudios de eficacia y seguridad en la neuralgia postherpética (NPH), neuropatía diabética dolorosa (NDD) y neuralgia del trigémino (NT) pero también se ha recogido la escasa bibliografía existente sobre el dolor neuropático central (DNC) y el dolor simpático (DS). A continuación reproducimos algunos de ellos.
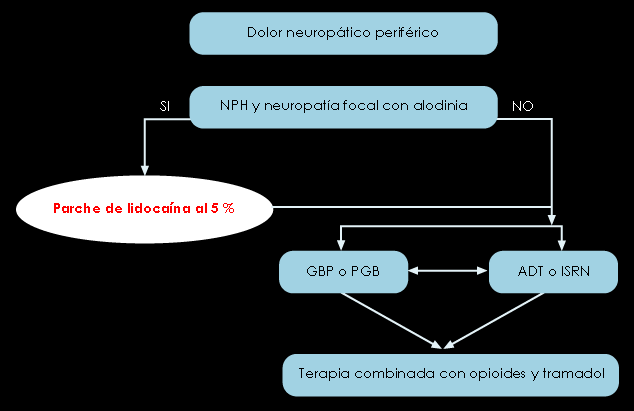
Figura 3. Algoritmo para el tratamiento del dolor neuropático periférico Finnerup et al.(13)
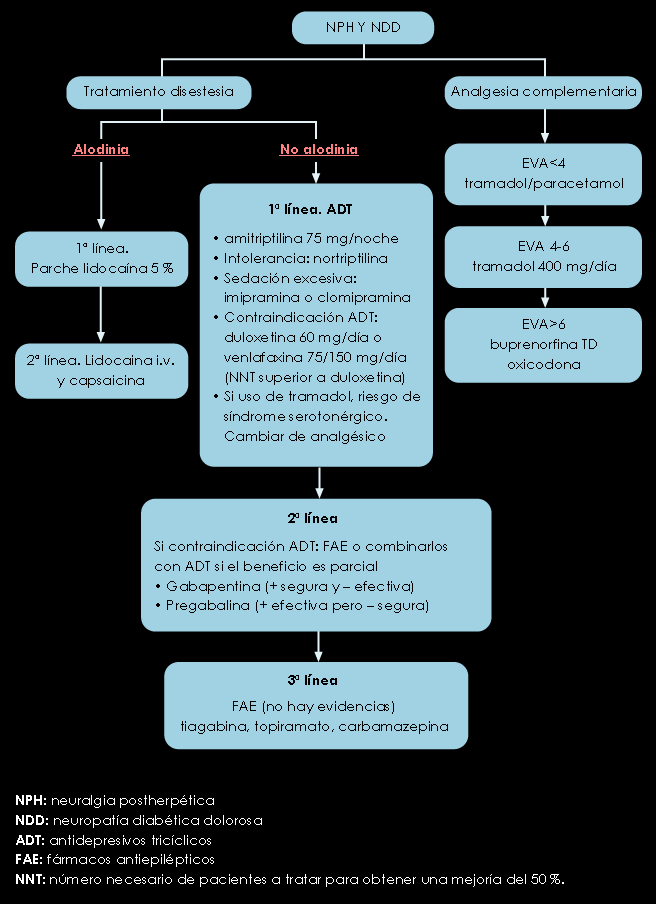
Figura 4. Algoritmo de tratamiento de la NPH y NDD
Figura 5. Algoritmo para el tratamiento de la neuralgia del trigémino (NT)
Figura 6. Algoritmo de tratamiento del (SDRC)
Figura 7. Algoritmo para el tratamiento del DNC
J. TRATAMIENTO FARMACOLÓGICO
Siguiendo el algoritmo de la figura 2, e insistiendo en que los estudios más numerosos son los realizados en la NPH, NDD y NT, se describen a continuación los fármacos de los que se dispone de distintos grados de evidencia y niveles de recomendación. En la situación actual puede extrapolarse el tratamiento a cualquier síndrome de dolor neuropático, adaptándolo a las características de cada cuadro y a la edad y patología asociada del paciente.
- Los ADT (amitriptilina) y los inhibidores duales (venlafaxina y duloxetina) son eficaces en el dolor continuo y paroxístico de la NDD y la NPH. Evidencia I-II; grado de recomendación A.
- Carbamacepina y oxicodona reducen el dolor evocado en la NT (IA) y son eficaces en las crisis de dolor espontáneo (IIB).
- Gabapentina (1.800 mg/día) asociada a opioides mejoran el dolor y la disestesia en DN por infiltración tumoral (IA).
- Gabapentina (2.400 mg/día) mejora el dolor en las primeras semanas en la NDD (IA). También la Capsaicina tópica (IA). Igual la Duloxetina (IA)
- Lamotrigina es eficaz en la Alodinia provocada por el frío y en el DNC postictal (IA).
- El dolor continuo, el paroxístico y el provocado por el roce, responden a oxicodona y/o tramadol (IA).
- Lidocaína tópica es eficaz sobre el dolor quemante y el provocado por el contacto (IIB).
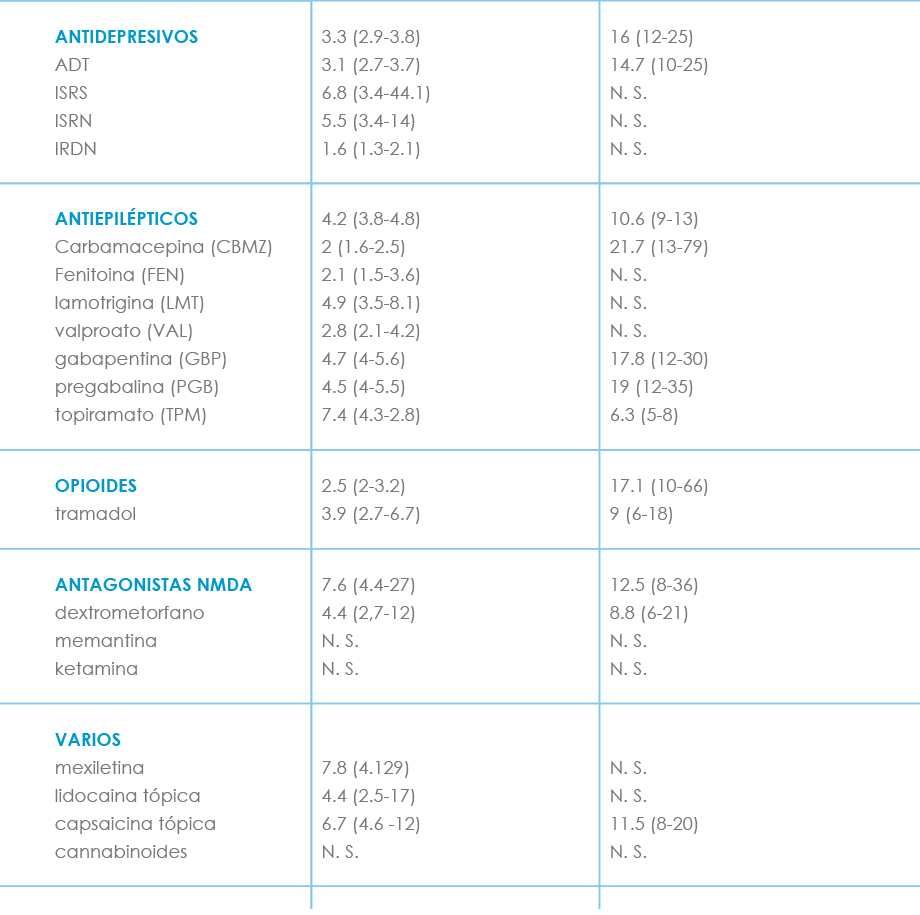
Tabla VII. Comparación de los diferentes fármacos utilizados en el dolor neuropático, según NNT Y NNH(13)(Finnerup)
A continuación se indicarán las recomendaciones de tratamiento farmacológico por patologías.
NEUROPATÍA DIABÉTICA DOLOROSA
Nivel de evidencia I; Grado de recomendación A: ADT, gabapentina, pregabalina, topiramato, duloxetina,venlafaxina, opioides potentes (oxicodona) y débiles (tramadol).
Nivel II; Grado B: lamotrigina se considera de tercera elección. Los de menor eficacia son capsaicina, ISRS, mexiletina, oxcarbacepina, memantina, mianserina y clonidina tópica.
Nivel III; Grado C: La carbamacepina presenta problemas de seguridad.
NEURALGIA POSTHERPÉTICA
Nivel I; Grado A: ADT, gabapentina, pregabalina y opioides como primera línea.
Nivel II; Grado B: lidocaína tópica, capsaicina, tramadol y valproato.
NEURALGIA DEL TRIGÉMINO
Nivel I; Grado A: carbamacepina y oxcarbacepina.
Nivel II; Grado B: oxicodona, como segunda línea. Baclofeno y lamotrigina pueden utilizarse de forma complementaria en pacientes refractarios a la primeria línea o que hayan rechazado la cirugía.
Nivel IIb; Grado B: La pregabalina presenta algunas ventajas sobre las del primer nivel, como su mejor tolerancia, más rápido inicio de acción y administración en sólo 2 tomas diarias.
DOLOR CENTRAL
La pregabalina es el único fármaco indicado como primera elección. Junto con GBP, LTG y ADT, son eficaces en el dolor postictal o lesión de la médula espinal (IA), aunque los ADT son mal tolerados en pacientes mayores de 70 años. (IIB). Los opioides son poco recomendables (III C).
Los cannabinoides muestran eficacia en el dolor de la esclerosis múltiple (IA).
DOLOR DE MIEMBRO FANTASMA
Nivel II; Grado B: pregabalina, gabapentina (2.400 mg/día) y opioides (sulfato de morfina 70-300 mg/día). Los ADT no han demostrado su eficacia.
K. PROCEDIMIENTOS TERAPÉUTICOS INVASIVOS
La base del éxito del tratamiento del DN reside en la rapidez de su inicio. Los tratamientos farmacológicos en ocasiones resultan ineficaces o son mal tolerados y por ello es fundamental comenzar el tratamiento más adecuado tras el diagnóstico porque la cronificación del proceso desencadena la aparición de mecanismos centrales y periféricos de sensibilización y modulación que amplifican la percepción del dolor. Esta situación hace necesaria la aplicación de procedimientos intervencionistas, que deben considerarse parte del abordaje multidisciplinar y tienen una triple utilidad: diagnóstica, pronóstica y terapéutica(14).
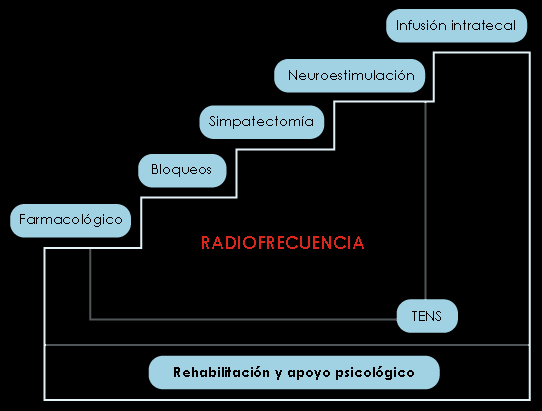
El enfoque debe basarse en una terapia escalonada para garantizar mayor eficacia con el menor riesgo y un coste razonable. En la Figura 8 se expone una escalera similar a la admitida por la OMS para el tratamiento farmacológico del dolor oncológico.
Figura 8. Escalera terapéutica intervencionista en el DN
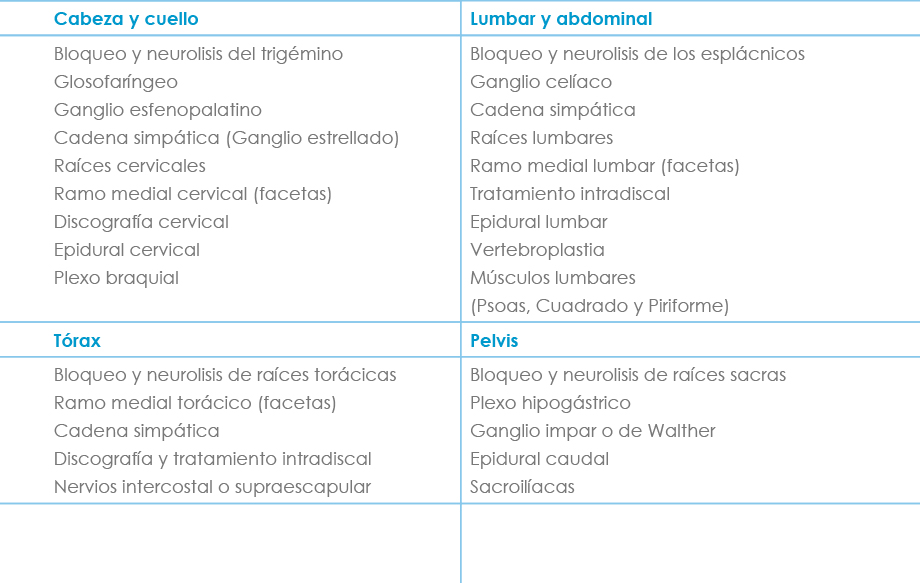
Tabla VIII. Posibilidades de tratamiento intervencionista del DN
1. Radiofrecuencia
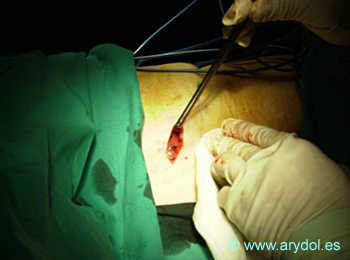
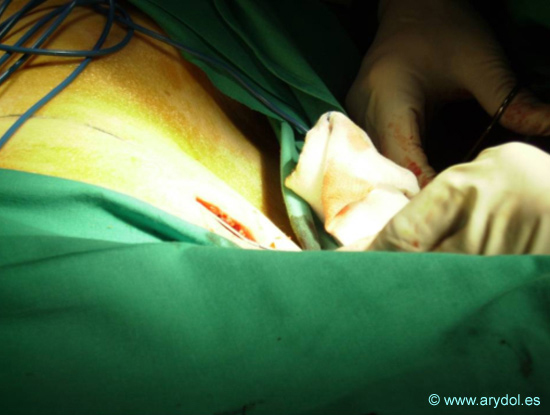
Como se desprende de la escalera de la Figura 8, la Radiofrecuencia puede realizarse en cualquier escalón antes de llegar a la Neuroestimulación y la infusión intratecal. Asimismo, en la Tabla VIII, se muestran todas las posibilidades de abordaje. La neurolisis ha sido el procedimiento más antiguamente utilizado para el tratamiento de determinados síndromes de dolor oncológico y – clásicamente – se han empleado alcohol o fenol (plexo celíaco, esplácnico, hipogástrico). La Radiofrecuencia es una técnica también conocida desde hace tiempo en su modalidad “convencional”, que implica una lesión a elevada temperatura (80 º) de una estructura nerviosa o simpática. Desde finales del siglo pasado se viene empleando la llamada “radiofrecuencia pulsada”, (Sluijter y Racz), que se diferencia básicamente de la convencional en que la “lesión” se realiza a unos 40 º, evitando la afectación del tejido circundante, que puede provocar la llamada “anestesia dolorosa”. La técnica consiste básicamente en la creación de un campo magnético a través de un electrodo cercano a la estructura afectada, únicamente activo en su tramo distal (punta activa), que puede oscilar entre 5 y 10 mm. El circuito se cierra con un electrodo pasivo conectado al paciente y a un equipo generador, que se muestra en la Figura 9.
Fig. 9
Generador de corriente de Radiofrecuencia
Para una información más detallada de la técnica, se remite al lector a los textos especializados. A continuación se representan algunas imágenes de los cuadros más significativos.
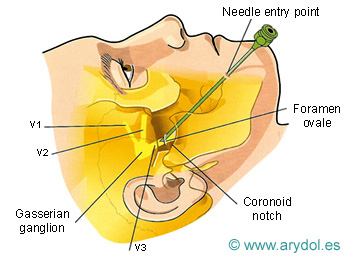
Fig. 10
Abordaje del foramen oval para el bloqueo del ganglio de Gasser en el tratamiento de la neuralgia del trigémino
Fig. 11
Foramen oval en proyección submentoniana. Obsérvese el electrodo de radiofrecuencia accediendo a la rama oftálmica, a la altura del último molar superior
Fig. 12
Visión lateral de la situación anterior. El electrodo no debe sobrepasar plano del clivus
Fig. 13
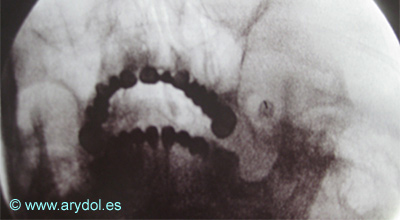
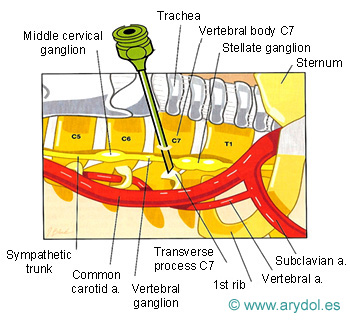
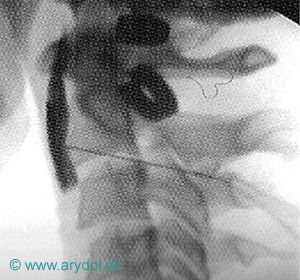
Localización del Ganglio estrellado, en la apófisis transversa de C7 (tubérculo de Chaissagnac) para el tratamiento del dolor simpático crónico de miembros superiores
Fig. 14
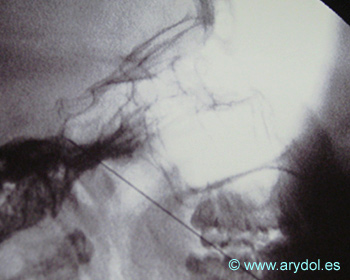
Distribución del contraste en el ganglio estrellado, conjunción de C5-C7
Fig.15
Bloqueo del ganglio de la raíz dorsal lumbar. Obsérvese la distribución del contraste a través de los forámenes de L2, L3, L4 y L5 (A B, C y D, respectivamente). Proyección oblicua.
Fig. 16
Bloqueo simpático lumbar
En la imagen izquierda, en proyección oblicua se observa la punta del electrodo situada por debajo de la apófisis transversa, que queda oculta por el cuerpo vertebral. En la imagen derecha, el contraste se distribuye por la cara anterior del cuerpo vertebral.
Fig. 17
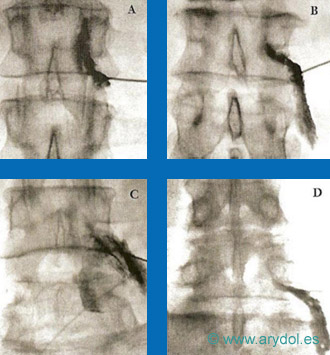
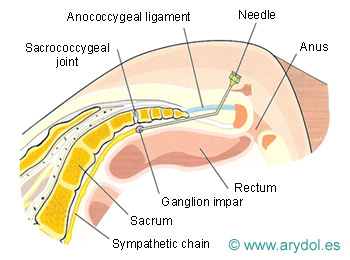
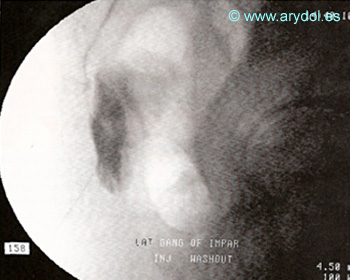
Localización y abordaje del ganglio impar, por delante del sacrocoxis
Fig. 18
Distribución del contraste “en gorro frigio” en el ganglio de Walther. Obsérvese la ampolla rectal, anterior al contraste
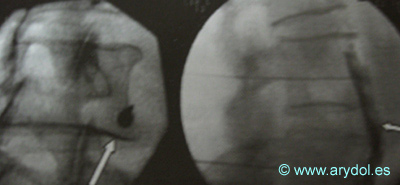
Fig. 19
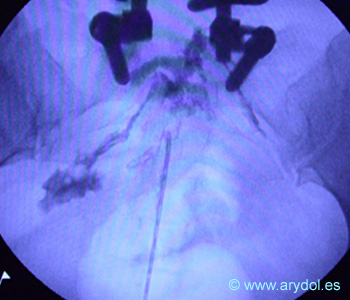
Epidurograma mediante abordaje caudal. Obsérvese la aguja de Tuohy y la distribución del contraste en las raíces sacras. El paciente está instrumentado y se aprecia un “stop” en la raíz de S2 derecha.
Fig. 20
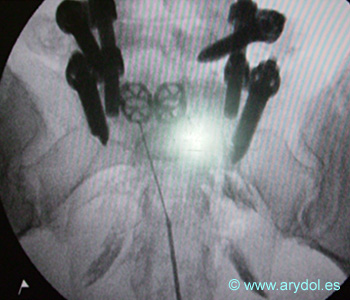
Catéter de Radiofrecuencia radicular lumbosacra.
Se aprecian los tornillos de instrumentación, las grapas utilizadas para fijar el injerto obtenido de la cresta iliaca y el catéter de radiofrecuencia sobre los forámenes de S2, S1 y L5 izquierdos.
2. Neuroestimulación
La electroestimulación medular (EEM) se viene utilizando como método invasivo para el alivio del dolor crónico desde el último cuarto del siglo pasado. Se basa en la “teoría de la puerta de entrada” (Melzack y Wall, 1965), que define el papel de la médula espinal en la modulación de la información sensitiva. Se considera un procedimiento del llamado “4º escalón” de la OMS y comprende tanto la estimulación de nervios periféricos (N. occipital en el tratamiento de la neuralgia de Arnold; N. genitocrural en el tratamiento de la cicatriz dolorosa post-hernioplastia) como la de los cordones posteriores, cerebral cortical y profunda. Resulta eficaz en el dolor neuropático, de localización unilateral pero también en dolor isquémico, tanto periférico (vasculopatía diabética, Raynaud), como en la cardiopatía isquémica. La mayor experiencia se centra en el tratamiento del llamado “Síndrome postlaminectomía”, conocido en la literatura anglosajona como “Síndrome de cirugía fallida de espalda (FBSS).
La técnica consiste básicamente en la colocación de un electrodo en el espacio epidural, sobre los cordones posteriores sensitivos de la médula espinal, que se conecta a un generador de corriente y provoca parestesias localizadas selectivamente en la zona dolorosa. Los electrodos más avanzados pueden llegar a estar constituidos por 8 polos (octapolares) con el fin de abarcar un área de estimulación mayor, dependiendo de cada caso. En la tabla IX se especifican las principales indicaciones.
Tabla IX. Indicaciones de la EEM en el DN
En las figuras 21 y 22, se representan los tipos de electrodos utilizados y su ubicación, una vez insertados en el espacio epidural.
El procedimiento se realiza bajo anestesia local, conectándose el electrodo a un generador de corriente, externo, que se mantendrá en periodo de prueba una o dos semanas. Si en ese plazo el paciente experimenta un alivio significativo de, al menos el 50 % en la intensidad del dolor, se decide el implante definitivo del generador, subcostal o supraglúteo, con una autonomía aproximada de un año,. El seguimiento y modificación de los parámetros de estimulación se realiza mediante “telemetría externa”.
Fig. 21
Material utilizado en la EEM
A. Electrodos tetrapolares
B. Generadores
Fig. 22
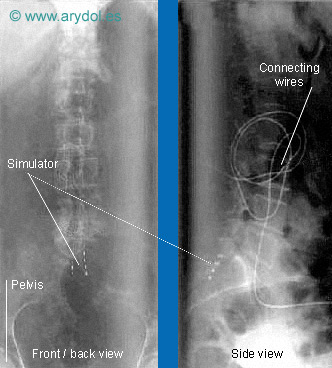
Colocación de los electrodos epidurales.
(X-rays of a person with a spinal simulator in place)
3. Infusión intratecal de fármacos
Procedimiento situado en el 4º escalón de la escalera de la OMS. Indicado cuando el dolor es incontrolable por otros métodos o los efectos secundarios de los fármacos por las vías convencionales son excesivos. La técnica consiste en la colocación de un catéter intradural conectado a una bomba que suministra la medicación, de forma continua o variable. Todo el sistema queda completamente internalizado y la bomba reservorio debe quedar en el compartimento subcutáneo (subcostal o supragúteo) de manera que esté accesible para su recarga desde el exterior.
En las figuras 23 a 29 se observa el implante de un catéter intratecal, con el paciente en decúbito lateral, su tunelización interna, con punto de salida en el flanco y la preparación del espacio subcutáneo en el que se colocará la bomba interna con el fármaco.
Fig. 23
Colocación de un catéter intratecal. Punción lumbar.
Fig. 24
Salida de líquido cefalorraquídeo (LCR).
Fig. 25
Introducción del catéter.
Fig. 26
Catéter situado intratecal. Aguja extraída.
Fig. 27
Tunelización del catéter.
Fig. 28
Preparación de la “bolsa de tabaco” para la bomba.
Fig. 29
Cierre de la “bolsa de tabaco” con el catéter ya tunelizado.
El fármaco más utilizado sigue siendo la morfina que – junto con el baclofeno y el ziconotide – son los únicos aprobados por la FDA. No obstante, en el consenso de Bruselas se estableció un algoritmo de dosis y concentraciones que no vamos a reproducir pero sí indicar que también se han utilizado por esta vía diversos anestésicos locales (bupi o ropivacaína), solos o asociados a morfina, la clonidina, el fentanilo, la meperidina, la ketamina, la neostigmina. La gabapentina y el midazolam. El ziconotide es el más novedoso. Se trata de un antagonista de los canales del calcio tipo N, obtenido del veneno segregado por un caracol marino (conus magnus). Está indicado cuando han fracasado todos los anteriores y debe titularse muy lentamente pues puede provocar náuseas y vómitos si se inicia a dosis elevadas. En la figura 30, el caracol marino del que se obtiene.
Fig. 30
Caracol marino “conus magnus”.
4. Otras técnicas de tratamiento no farmacológico
- TENS (estimulación eléctrica transcutánea); Estimulación interferencial; PNT (neuromodulación percutánea).
- Iontoforesis (aplicación de corriente galvánica para introducir fármacos en forma de iones a través de la piel).
- Bloqueos regionales endovenosos con isquemia regional.
- Toxina botulínica intramuscular para el dolor miofascial.
- Ozonoterapia. Controvertida en el momento actual. No se dispone de evidencia.
I. TERAPIA PSICOEDUCATIVA
La peculiaridad del dolor neuropático con respecto a otras sintomatologías dolorosas estriba en que el estímulo doloroso no se corresponde con la activación de un nociceptor, de modo que nuestro Sistema Nervioso Central (SNC) interpreta como dolorosos estímulos que habitualmente no lo son. Estas características dificultan la interpretación de los síntomas por parte de los profesionales y su comprensión por los pacientes. La prevención de su aparición debe corresponder al nivel de Atención Primaria. La enfermedad y el dolor precisan una constante adaptación del paciente a su entorno y su afrontamiento provoca respuestas emocionales intensas que dificultan la práctica de las actividades habituales de la vida diaria. La mayor efectividad en su tratamiento se consigue mediante un abordaje multidisciplinar en el que deben participar médicos de diversas especialidades, psicólogos, fisioterapeutas y trabajadores sociales. La cronificación del dolor predispone a padecer psicopatologías y la muy frecuente asociación de estados depresivos tiene su base química puesto que ambas situaciones (depresión y dolor) comparten mecanismos neuroendocrinos e inmunológicos (vías noradrenérgicas y serotonérgicas de transmisión). Las Unidades del Dolor deben disponer de un psicólogo clínico, que debe evaluar a todos los pacientes con dolor neuropático. La aplicación de terapias psicoeducativas grupales resulta de gran ayuda para los pacientes, que “aprenden a convivir con su dolor” y pueden modificar otras actitudes ante el problema sociolaboral y familiar creado, como la propia autoestima. La terapia congnitivo-conductual se aplica cada vez con más frecuencia en el dolor crónico y debe basarse en varios principios:
- Asumir que los pensamientos influyen tanto en los sentimientos como en el comportamiento.
- La utilización de técnicas estructuradas puede ayudar a los pacientes a identificar su comportamiento y los pensamientos desadaptativos.
- El aprendizaje de técnicas que puedan aplicar los pacientes les ayuda a combatir sus problemas.
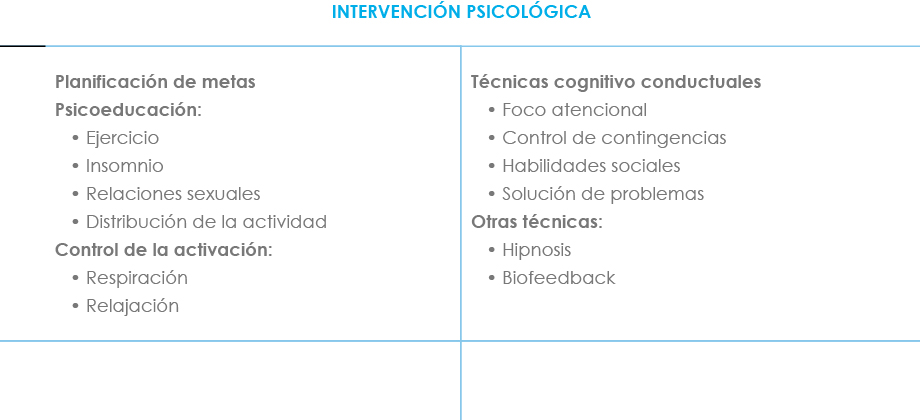
En la tabla X se recogen las principales técnicas de aplicación psicológica aplicables a pacientes con DN.
Tabla X. Técnicas de intervención psicológica en el DN
Para consultar mayores detalles de dichas técnicas se remite al lector a los textos especializados, dado que no son subsidiarias de más amplio comentario en el tema que nos ocupa.
J. EL FUTURO
En el momento actual, el dolor neuropático ha adquirido una gran incidencia en la población, cuyo tratamiento está lejos de la excelencia. Por ello se hace necesaria la búsqueda de nuevas terapias que deberían satisfacer los siguientes criterios: 1/ aumentar la eficacia; 2/ aumentar la respuesta y 3/ disminuir los efectos adversos. A continuación se revisan algunas de las dianas terapéuticas en las que se trabaja y que han mostrado resultados esperanzadores en modelos preclínicos. También se buscan nuevas dianas no neuronales en el sistema inmune. La terapia génica y la de trasplante son también buenas esperanzas para el tratamiento e incluso la curación del DN.
Canales iónicos
- Canales de sodio resistentes a tetrodotoxina Nav 1.8. Se expresan predominantemente en las fibras C amielínicas. Su expresión está muy restringida y es una clara diana para el futuro.
- Canales de sodio sensibles a tetrodotoxina Nav 1.3. Esta subunidad no se expresa habitualmente en grandes proporciones.
- Canales de calcio voltaje=dependientes tipo N. Son inhibidos por algunos miembros de la familia de la w-conotoxina, obtenida del caracol marino (conus magnus), como el ziconotide, ya disponible en España desde hace unos años para su uso intratecal.
- Canales de calcio tipo T. Se expresan en las fibras C y A& de los terminales nerviosos periféricos y pueden constituirse como posible diana terapéutica antineuártiopáca [15] (Etosuximida).
- Subunidad a2&-1 de los canales de calcio sensibles a voltaje. de las tres subunidades reguladoras que configuran el poro de la subunidad a1. Está sobreexpresada en las neuronas del ganglio de la raíz dorsal tras un traumatismo neural. La gabapentina y la pregabalina bloquean dichos canales y de ahí su eficacia en el tratamiento del DN.
- Canales TRPV (transient receptor potencial). Pertenecen a la familia de los receptores de los canales catiónicos no selectivos. El canal TRPV1 se identificó como un receptor vaniloide y para capsaicina, además de su activación por temperaturas superiores a 42 º C.
- Receptores P2X3 y P2X4. Se expresan de forma predominante en neuronas sensitivas implicadas en el procesamiento del dolor tras la liberación de ATP en tejidos dañados[16].
- Receptores endocannabinoides. Los receptores CB1 Y CB2 median los efectos farmacológicos de los endocannabinoides. Los cannabinoides sintéticos (tetrahidrocannabinol) aun están extensamente considerados como sustancias ilegales aunque en algunos países (Canadá) y en alguna Comunidad Autónoma del nuestro, están autorizados para el tratamiento del dolor oncológico y del dolor neuropático en la esclerosis múltiple, así como de los efectos adversos de otros opioides[17].
- Receptor opioide -&. Se busca la eficacia de agonistas selectivos de este receptor opioide, que carezcan de los efectos adversos de los agonistas µ y K.
- Receptores acoplados a proteína G (GPCR´s). Íntimamente ligados a la modulación del dolor, representan una de las mayores fuentes de posibles dianas farmacológicas.
- Protein-kinasas activadas por estrés o por mitogénesis.
- Células madre embrionarias.
- Terapia génica.
- Anticuerpos terapéuticos.
BIBLIOGRAFÍA
- Hansson P, Lacerenza M, Marchetini P. Aspects of clinical and experimental neuropathic pain: The clinical perspective. En Hansson P et al (eds). Neuropathic pain: pathophisiology and treatment. Progress in Pain Research and Management. IASP Press, Seattle 2001; pp.1-18.
- Sinnott C. Neuropathic Pain. CME Bull: Palliat Med 1998; I:7-9.
- MacFarlane BV, Wright A, O´Callaghan J et al. Chronic neuropatic pain and its control by drugs. Pharmacol Ter, 1997; 77:1-19.
- Chapman CR, Hill HF, Saeger L, et al. Profiles of opioid analgesia in humans after intravenous bolus administration: alfentanyl, fentanyl and morphine compared on experimental pain. Pain. 1990; 43:47-55.
- Indo Y. Molecular basis of congenital insensitivity to pain with anhidrosis (CIPA): Mutations and polymorphisms in TRKA (NTRK) gene encoding the receptor tyrosine kinase for nerve growth factor. Hum Mut, 2001; 18:462-471.
- Mattson P, Bjelfman C, Lundberg PO et al. Cytochrome P450 2D6 and glutathione-S-transferase M1 genotypes and migraine. Eur J Clin Invest, 2000; 30:367-371.
- Brooks B, Delaney-Robinson C, Molyneaux L, Yue DK. Endothelial and neural regulation of skin microvascular blood flow in patients with diabetic peripheral neuropathy: effect of treatment with the isoform-specific protein kinase C beta inhibitor, ruboxistaurin. J Diabetes Complications. 2008;22:88-95.
- Sadosky A, McDermott AM, Brandenburg NA, Strauss M. A review of the epidemiology of painful diabetic peripheral neuropathy, postherpethc neuralgia, and less commonly studied neuropathic pain conditions, Pain Pract. 2008;8:45-56.
- Janetta PJ. Arterial compression of the trigeminal nerve at the pons in patients with trigeminal neuralgia. J Neurosurg. 1967;26 Suppl:159-62.
- Nadjarian R. A review of complex regional pain syndrome. Semin Anesth. 2003;22:144-51.
- Modificada del libro “Guía Buena Práctica Clínica en Dolor Neuropático”, editado por la SED (IM&C) en 2008; ISBN: 978-84-691-2470-3; pp: 21-26.
- González-Escalada J.R., Rodríguez M.J., Camba M.A., Portolés A., López R. Recomendaciones para el tratamiento del dolor neuropático. Rev Soc Esp Dolor. 2009;16(8):445-467.
- Finnerup NB, Otto M, McQuay HJ, Jensen TS, Sindrup SH: Algorithm for neuropathic pain treatment: an evidence based proposal. Pain 2005;118:289-305.
- Dolor neuropático. Editor: José Ramón González Escalada. Editorial de la SED 2006; ISBN: 84-611-1009-9.
- Flatters SJ, Bennett GJ. Ethosuximide reverses paclitaxel – and vincristine – induced painful peripheral neuropathy. Pain. 2004;109:150-161.
- North RA. The P2X3 subunit: a molecular target in pain therapeutics. Current Opin Investig Drugs. 2003; 4:833-840.
- Manzanares J, Julian MD, Carrascosa A. Role of the cannabinoid system in pain control and therapeutic implications for the management of acute and chronic pain episodes. Current Neuropharm. 2006;4:127-138.