Dolor irruptivo
Dra. Esperanza Ortigosa, Dr. Jesús Estrada, Dra. Sara Arias, Dra. Consuelo Fernández - Hospital Universitario de Getafe
INTRODUCCIÓN
El dolor representa el síntoma principal en un tercio de los pacientes con cáncer en fase inicial, y en dos terceras partes de enfermos con enfermedad en estadíos muy avanzados. Se trata de un dolor agudo prolongado, no tiene propósito y es desmoralizante, llegando a dominar y aislar al paciente del mundo exterior.
Se ha estimado que aproximadamente dos de cada tres enfermos con dolor oncológico crónico sufren además con cierta frecuencia exacerbaciones puntuales del mismo, debido a causas, unas veces previsibles y otras inesperadas. Además del sufrimiento que suponen para el paciente, estos episodios constituyen un problema importante asociado al dolor pues generan ansiedad y añaden incapacidad funcional, lo cual se traduce en una mayor dificultad para controlar el dolor basal y una menor calidad de vida.
El tratamiento eficaz de este trastorno implica asumir el concepto actual de "dolor total", que es aquél que requiere cuidados continuos y enfoque multidisciplinar.
RECUERDO HISTÓRICO
La primera vez que se utilizó el concepto de "breakthrough pain"(1) fue en Estados Unidos en 1990 donde Portenoy y Fine acuñaron el término, para definir las exacerbaciones transitorias de un dolor oncológico, que está bien controlado con la utilización de opioides mayores.
En España en el año 2002, la Sociedad de Oncología Médica (SEOM), la Sociedad Española de Cuidados Paliativos (SECPAL) y la Sociedad Española del Dolor (SED), establecieron un documento de consenso en el que asumieron el término "dolor irruptivo"(2).
DEFINICIONES
Dolor: se define como una experiencia sensorial y emocional desagradable asociada a un daño tisular real o potencial(3).
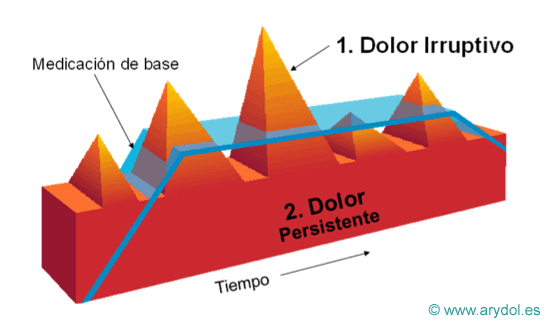
Dolor de fondo: Se refiere a un dolor de base constante y continuo de larga duración. Cabe señalar que cuando hablamos de “larga duración “nos estamos refiriendo a más de 12 h. al día(4).
Dolor irruptivo: Se utiliza este término para definir una exacerbación del dolor de forma súbita y transitoria, que aparece sobre la base de un dolor de fondo persistente, que por otra parte es estable y está adecuadamente controlado(5).
Dicho de otro modo es un dolor agudo dentro de la cronicidad del dolor, que debe cumplir las siguientes premisas:
- Intensidad > 7 en la EVA.
- Rapidez de instauración 1-5 minutos.
- Corta duración usualmente inferior a 20-30 minutos.
Aparece sobre la base de un dolor persistente, estable y tolerable (EVA < 5). Es habitual la fluctuación del dolor relacionado con las enfermedades como el cáncer y los pacientes suelen presentar exacerbaciones transitorias.
Fig. 1
Componentes del dolor crónico oncológico
Aunque el término dolor irruptivo se ha aplicado exclusivamente a los pacientes oncológicos e incluso los nuevos fármacos con base de fentanilo tienen esta limitación en la ficha técnica, en la práctica clínica no solo nos vamos a encontrar con dolor irruptivo en pacientes oncológicos sino también en los que tienen dolor crónico no maligno. De hecho ya hay un trabajo de Zepetella(6) en el 2001 en el que concluye que hay una incidencia del 63% en este tipo de pacientes con dolor no oncológico.
ETIOLOGÍA
La etiología del dolor irruptivo es, a menudo, la misma que la del dolor de fondo(7).
El origen de estas crisis en los pacientes con cáncer puede radicar en:
- La progresión del tumor: una de las causas más frecuentes que dan lugar a dolor irruptivo son las metástasis óseas. Producen un dolor insoportable, que dura pocos minutos y que suele desaparecer generalmente con el cambio de posición, con el reposo, etc.
- El tratamiento concomitante del propio cáncer ( neuropatía postquimioterapia, mucositis postradioterapia).
- El debilitamiento secundario que sufre el paciente por la enfermedad.
- El efecto de enfermedades concomitantes que aparecen en el contexto de la enfermedad de base(8) como son la cefalea tensional, el estreñimiento, las fisuras anales etc.
Debemos tener en cuenta que los pacientes pueden sufrir accesos de dolor irruptivo en cualquier etapa del proceso oncológico: durante el diagnóstico, el tratamiento, la fase de remisión, recaídas etc.(1,7,8) y que con frecuencia afecta a pacientes con metástasis óseas, con cáncer de próstata, de mama y en mielomas tanto en hombres como en mujeres. Cualquier microfractura a veces no apreciable puede provocar dolor irruptivo ante cualquier movimiento, tras la micción, tras la ingesta en pacientes con cáncer de páncreas, en tumores de mama o pulmón, en los que la incidencia de dolor neuropático es muy elevada.
También hay otros factores que influyen en la aparición del dolor irruptivo aunque no sabemos en qué medida, como los cambios climáticos, anímicos, alteraciones hormonales, etc.
A pesar de lo expuesto, cuando profundizamos en la etiología del dolor irruptivo de los pacientes con cáncer, tenemos que reconocer que en más del 50% de los casos no conocemos el origen, lo cual nos dificulta el tratamiento.
PREVALENCIA DEL DOLOR IRRUPTIVO
Como ya hemos comentado el dolor es un síntoma frecuente entre los enfermos oncológicos. La prevalencia del dolor oscila entre el 30-40% en los pacientes con enfermedad en fase inicial que están recibiendo tratamiento y un 70-80% en los pacientes con enfermedad avanzada.
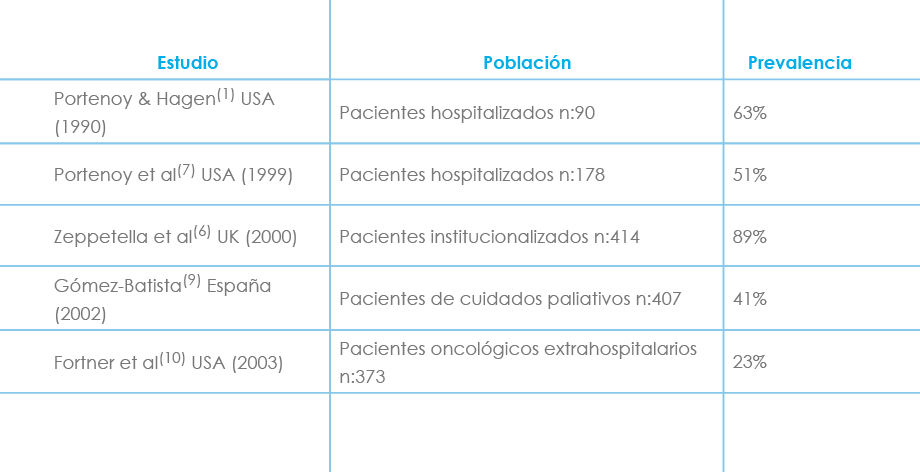
En cuanto al dolor irruptivo hay una gran disparidad en cuanto a las cifras de prevalencia que oscilan entre 19% -95% según los distintos grupos de estudio. Estas diferencias se justifican en primer lugar por la zona geográfica estudiada ya que generalmente los países anglosajones recogen más y mejores datos que los países mediterráneos, africanos, y asiáticos. Pero también influye la metodología utilizada, la población estudiada, y la ausencia de criterios homogéneos de diagnóstico.
La mayoría de los autores han adoptado como criterios diagnósticos de inclusión del dolor irruptivo aquellos ya empleados por Portenoy y Hagen en 1990(1).
- Presencia de analgesia estable las 48h previas.
- Dolor de fondo controlado las 24h. previas.
- Existencia de accesos de dolor intenso o insoportable las 24h. previas.
En cuanto a la frecuencia y duración, los distintos trabajos exponen frecuencias entre 3 y 6 episodios al día y una duración de 30-50 minutos.
Tabla: Prevalencia del dolor irruptivo
En el último estudio pan-europeo(11), realizado en 11 países de Europa e Israel y publicado en el 2009 concluye:
- Un 63% de los pacientes sufre dolor irruptivo a pesar de tener un tratamiento analgésico de base.
- Un 69% informó dificultades en la realización de sus actividades cotidianas provocadas con el dolor.
- Un 50% cree que los profesionales sanitarios encargados de su salud no consideraban su calidad de vida una prioridad en la atención general.
CARACTERÍSTICAS CLÍNICAS
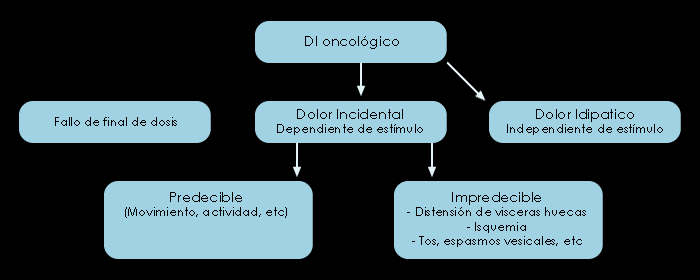
Aunque el dolor irruptivo no es una sola entidad sino un espectro de varias entidades y las características clínicas pueden variar de unos pacientes a otros e incluso modificarse en un mismo paciente con el tiempo(12). De forma general podemos clasificar el dolor irruptivo en tres tipos:
Dolor irruptivo incidental. Se le relaciona fácilmente con un factor causal conocido y previsible, que puede ser voluntario o involuntario. Entre los factores voluntarios se encontraría la ingesta (en pacientes con mucositis oral o esofágica), deposición (en pacientes portadores de tumores pélvicos), roce en áreas con alodinia en pacientes con dolor neuropático, etc… Los no voluntarios generalmente son inducidos por procedimientos terapéuticos como movimientos del paciente en la cama, cambios posturales, etc... Este tipo de dolor debe manejarse de forma profiláctica(13).
Dolor irruptivo idiopático o espontáneo. Sin relación causal. Los episodios no están relacionados con un factor precipitante, sino que aparecen de forma imprevisible(14) sin que exista un factor desencadenante habitual. Ejemplo de dolor idiopático es el que aparece con las contracciones musculares(15).
Dolor irruptivo por fallo de final de dosis(16,17). No debería considerarse como dolor irruptivo ya que es una consecuencia de un ajuste incorrecto de la pauta para el dolor persistente de base. Aparece antes de la teórica siguiente dosis de analgésico y se debe a una infradosificación del analgésico de base. Habitualmente ocurre en el periodo de titulación de dosis, o porque hay una prescripción de intervalos demasiado largos entre las dosis. Esta situación se suele resolver aumentando la dosis del opiáceo de base o disminuyendo los intervalos de administración.
Clasificación según Fisiopatología:
Nociceptivo: Este tipo de dolor se debe a la estimulación de las terminaciones nerviosas y se divide en dos tipos.
- Somático: se puede producir en todos los tejidos del organismo. Es un dolor continuo, palpitante, punzante y bien localizado.
- Visceral: se produce en los órganos profundos y es sordo, continuo y mal localizado.
Neuropático: Lesión del sistema nervioso, con sensibilización periférica y de características peculiares (quemante, hormigueo, lancinante, paroxístico).
Se trata mejor con fármacos adyuvantes.
Hay algunos autores que consideran que este último no debería ser incluido dentro del dolor irruptivo, ya que es tributario de un tratamiento muy específico puesto que, en general, es muy refractario a los opioides.
No ocurre así con el dolor nociceptivo que, independientemente del tipo que sea y en función de la descripción del proceso, puede ser perfectamente controlado mediante un tratamiento con opioides.
Mixto: Combinación de dolor neuropático y nociceptivo.
Dentro de este apartado debemos destacar algunas características intrínsecas al dolor irruptivo que complican su adecuado control: Está producido por diferentes etiologías y por tanto un mismo paciente puede sufrir diferentes tipos de dolor irruptivo, especialmente cuando la enfermedad se encuentra en situación avanzada(18).
La evolución impredecible de la enfermedad oncológica hace que ésta pueda invadir nuevas áreas y aparezcan nuevas crisis de dolor en pacientes que estaban estabilizados. La complejidad de algunas de estas algias es tal que podemos tenerlas controladas en determinadas circunstancias (como el reposo) pero sufrir exacerbaciones con acciones como la deglución, la micción o incluso de forma espontánea, sin causa aparente. La elevada intensidad de estas crisis en comparación con el dolor basal deteriora física y anímicamente al paciente en un corto espacio de tiempo.
Por otra parte, parece ser que existe un ritmo circadiano en el dolor de fondo en los pacientes con cáncer(19).
DIAGNÓSTICO Y EVALUACIÓN
El manejo adecuado del dolor irruptivo depende de un diagnóstico y evaluación adecuada.
Es fundamental en estos pacientes conocer las características del dolor que presentan, para conseguir buenos resultados terapéuticos. Se debe investigar la intensidad y localización del dolor persistente que padece el paciente así como el número de episodios de dolor irruptivo, su intensidad y su evolución temporal, ya que este último dato nos puede indicar si su aparición se debe a un deficiente ajuste en el régimen posológico del tratamiento para el dolor persistente que estamos aplicando, o bien a la progresión de la enfermedad, hecho que todos tenemos que asumir, ya que el cáncer es un proceso evolutivo en el tiempo.
En la consulta debemos evaluar los siguientes puntos:
- Tipo de dolor irruptivo
- Número de episodios/día
- Forma de inicio
- Intensidad y duración de los episodios Localización e irradiación
- Presencia de factores precipitantes/aliviadores Síntomas asociados
- Respuesta al tratamiento
- Interferencia con la vida diaria
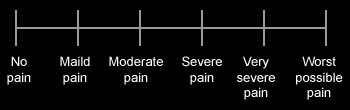
Las escalas unidimensionales valoran la intensidad del dolor con independencia de las demás características del dolor irruptivo oncológico[20,21].
Escala de intensidad numérica
Escala de intensidad descriptiva
Escala de valoración de caras de dolor de Wong-Baker
Las herramientas multidimensionales incorporan escalas que permiten una amplia caracterización del DI oncológico en un único paso.
Ejemplo de herramienta multidimensional de valoración del dolor: agenda del dolor.
Fig. 2
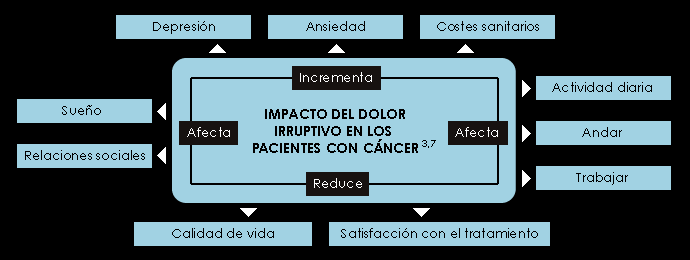
COMPLICACIONES DEL DOLOR IRRUPTIVO
Las complicaciones son numerosas pero se resumen en una pérdida de la calidad de vida del paciente.
Físicas: el dolor irruptivo se asocia con una variedad de problemas físicos, especialmente en pacientes cuyas crisis de dolor están relacionadas con los movimientos voluntarios, ya que el enfermo tratará de evitar este tipo de acciones(22).
Como resultado, los pacientes desarrollan complicaciones como atrofia muscular, rigidez en las articulaciones, dolores a la presión, estreñimiento, trombosis venosa profunda, problemas respiratorios, taquicardias, crisis anginosas que incluso pueden derivar a un infarto agudo de miocardio y otras.
A ello debe añadirse una clara interferencia con el sueño ya que parece que tanto el dolor de base como el irruptivo están sujetos a un cierto ritmo circadiano.
Psicológicas: Se asocia con alteraciones en el carácter y el estado de ánimo, depresión y ansiedad(23).
Sociales: Durante las crisis de dolor irruptivo el paciente tiene grandes dificultades o es totalmente incapaz de realizar sus actividades diarias lo que se traduce en una mayor dependencia de sus cuidadores. La mayoría no están en condiciones de trabajar, situación que repercute gravemente en la economía propia y familiar.
Por último el deterioro anímico, la depresión y la ansiedad terminan también minando sus relaciones sociales.
TRATAMIENTO
Principios generales
El manejo adecuado del dolor irruptivo se basa en tres aspectos: prevención, anticipación y uso de medicación adecuada.
Prevención: El dolor irruptivo debe ser evitado mejor que tratado, y para ello es clave hacer una adecuada titulación de la analgesia de base. Esta maniobra disminuye la frecuencia de dolor incidental, evita el dolor del final de la dosis y facilita el control de los episodios de dolor incidental.
Anticipación: consiste en tener previsto el manejo del dolor irruptivo, dejando prescrita de antemano medicación “de rescate” que en caso de aparición del dolor será administrada.
Uso de medicación adecuada: Es igualmente importante seleccionar el fármaco adecuado en función del dolor que presenta el paciente. La dosis empleada se deberá determinar en función de las características del paciente y de la situación en que se encuentre, teniendo en cuenta, además, que ésta debe ser administrada por la vía apropiada. Nuestro objetivo será prescribir un tratamiento preciso, en los intervalos adecuados, tratando el dolor persistente de fondo y aliviando los accesos de dolor irruptivo, y todo ésto con los menores efectos secundarios posibles.
Aunque en el pasado se ha recomendado que el tratamiento de rescate para el dolor irruptivo debía hacerse con el mismo opioide utilizado como medicación de base(23), no hay razones de peso que nos indiquen que siempre debemos usar el mismo opioide; se recomienda utilizar un fármaco u otro en base a su perfil farmacocinético más que a sus característica farmacodinámicas(24).
En algunos casos, incluso es preferible emplear un fármaco diferente, precisamente para intentar evitar la sumación de efectos secundarios.
Vías de administración
Vía oral
Las guías clínicas de la OMS recomiendan el uso de la vía oral como primera elección en el manejo del dolor oncológico(25). Sin embargo, aunque la vía oral es muy efectiva para el tratamiento del dolor de fondo, en general es menos eficaz para el manejo del dolor irruptivo(26).
Se dispone de una serie de opioides orales para el tratamiento del dolor moderado severo como:
Sulfato de morfina:
El sulfato de morfina de liberación inmediata (Sevredol®, Oramorph®), es la alternativa para el uso de morfina por vía oral. Su efecto comienza a notarse a los 20-30 minutos, alcanza su pico máximo en torno a la hora y prolonga sus efectos durante 3-4 horas. Es una buena opción sobre todo para dolores incidentales en los que se puede anticipar aproximadamente el momento de aparición, la duración e intensidad del mismo. También es útil para cubrir la analgesia durante los momentos iniciales o finales de una dosis de morfina de acción prolongada. Su eficacia en el dolor irruptivo idiopático o espontáneo está limitada por el tiempo de latencia hasta la aparición del efecto analgésico, y la dificultad para dosificar de forma repetida. En pacientes sin titulación opioide previa, la dosis inicial debe ser de 5–10 mg, pero no se debería repetir hasta pasadas 2 horas, para evitar sobredosificaciones debidas a retardos en la absorción.
Las presentaciones de las que disponemos en España son:
- Oral Sevredol®, comprimidos de 10 y 20 mg
- Oramorph® 2 mg/ml solución oral, 30 unidosis de 10 mg.
- Oramorph® 6 mg/ml solución oral, 30 unidosis de 30 mg.
- Oramorph® 20 mg/ml solución oral, 30 unidosis de 100 mg.
- Oramorph® 2 mg/ml solución oral en frasco de 100 o 250 ml.
- Oramorph® 20 mg/ml solución oral en frasco de 20 o 100 ml.
El envase de 20 ml incluye gotero dosificador; 8 gotas: 10 mg.
Oxicodona Oral:
OxyNorm® cápsulas de 5 mg, 10 mg y 20 mg y solución oral de 30 ml (10 mg/ml). Tras la administración de OxyNorm® cápsulas, las concentraciones plasmáticas aumentan de manera lineal a la dosis; para un intervalo de dosis de 5–20 mg, alcanzan el máximo tras aproximadamente 1 hora, y su semivida de eliminación es de aproximadamente 3 horas.
Ventajas de la vía oral(27,28):
- Bien aceptada por pacientes, familiares y profesionales de la salud.
- Gran variedad de compuestos opioides orales disponibles en España.
Desventajas de la vía oral:
- Los opioides orales de acción corta disponibles no cumplen los requisitos exigibles para tratar el dolor irruptivo.
- Su pico plasmático aparece entre 30 y 60 minutos después de su administración.
- No es una vía adecuada para los pacientes con disfagia, náuseas o vómitos.
Vía parenteral
Cloruro mórfico:
El cloruro mórfico por vía parenteral se puede administrar a todo tipo de pacientes pues no requiere indemnidad de la vía oral ni digestiva. Es una buena solución de forma puntual para pacientes hospitalizados, o para utilización por personal cualificado de equipos de soporte domiciliario. La vía parenteral permite la administración exacta de la dosis de morfina elegida, y su efecto es muy rápido, tanto por vía intravenosa (5 minutos), como por vía subcutánea o intramuscular (5–20 minutos). La morfina por vía intravenosa se debe infundir a una velocidad menor a 2 mg/minuto. En pacientes sin dosis analgésica titulada, debemos comenzar por 4–5 mg, y repetir dosis hasta desaparición del dolor o presencia de signos de toxicidad (cada 20 minutos si se usa por vía intravenosa o cada 40–60 minutos con la vía intramuscular). En pacientes con tratamiento de base, la administración parenteral de un 20% de la dosis basal es bastante segura.
Presentación:
Ampollas al 1 % (1 cc = 10 mg) y al 2% (1 cc = 20 mg)
Administración cada 4 horas (iv, im. o sc) o en perfusión continua.
Ventajas de la vía intravenosa:
- Se puede administrar en todo tipo de pacientes.
- Es bien aceptada cuando los pacientes padecen dolor de intensidad severa.
Desventajas de la vía intravenosa:
- Precisa una vía de acceso adecuada con el riesgo que supone de lesiones locales, infecciones etc.
- Requiere dispositivos específicos (bombas de infusión, elastómeros).
- Personal con unos conocimientos y cierto entrenamiento para poder realizar la técnica.
- No es bien aceptada por el paciente cuando el dolor tiene una intensidad leve o moderada.
ABORDAJE ACTUAL DEL DOLOR IRRUPTIVO
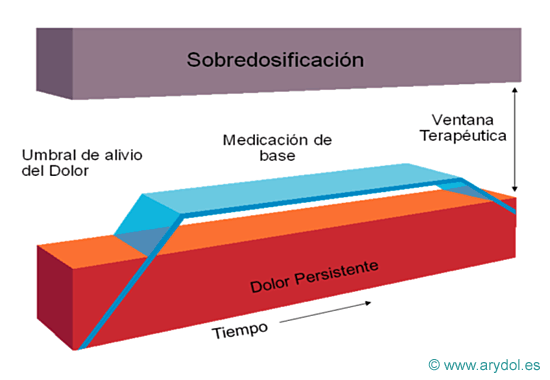
El dolor oncológico de base se trata mediante analgésicos opioides de larga duración cuyas dosis deben ajustarse para controlar que el grado de analgesia obtenida sea el óptimo con los mínimos efectos indeseables.
Fig. 3
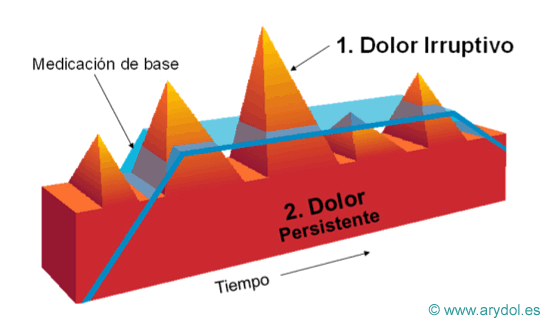
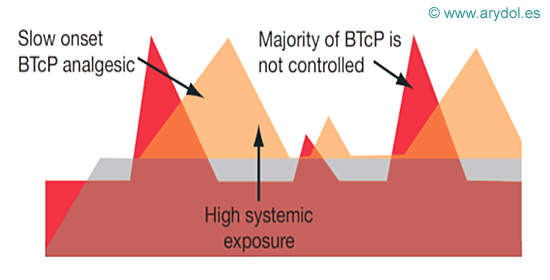
Cuando ocurre una exacerbación del dolor de forma súbita y transitoria sobre el dolor de fondo persistente, la medicación pautada para el control del dolor de base no es suficiente por lo que como vemos en la imagen aparecen picos de dolor no controlado.
Fig. 4
Los fármacos utilizados hasta hace poco tiempo tienen un efecto analgésico lento, con lo que su acción no coincide con el pico de dolor irruptivo.
Fig. 5
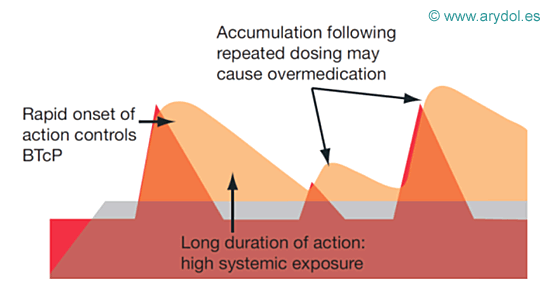
Además si se intenta manejar las crisis de dolor irruptivo mediante el aumento de dosis y la frecuencia de la medicación de base, es muy probable que aparezcan efectos indeseables por sobredosificación.
Fig. 6
El manejo óptimo del dolor irruptivo por lo tanto requiere una evaluación independiente y tratamiento específico.
Ya hemos visto que las especiales características del dolor irruptivo hacen necesario que el opiáceo utilizado en su tratamiento sea potente, de acción rápida y fácil de administrar (incluso por el propio paciente). Asimismo también necesitamos una vía no invasiva y cómoda para el paciente.
¿Qué características debería tener el fármaco ideal?
- Gran rapidez de acción combinado con una duración de efecto corta.
- Potencia analgésica elevada.
- Debe ser útil para el tratamiento del dolor nociceptivo y somático.
- Dosis/efecto controlable.
- Mínimos efectos secundarios.
- No invasivo, fácil de usar y de gran seguridad.
- Tener una buena relación efectividad/precio.
Fig. 7
Agente ideal teórico para el DI Oncológico.
El agente analgésico se adapta íntimamente al perfil temporal del dolor irruptivo.
Su corta duración de acción minimiza la exposición sistémica.
¿Qué características debería tener la vía de administración ideal?
- No invasiva.
- Aceptada por pacientes y profesionales.
- No debe requerir dispositivos específicos (bombas de infusión, elastómeros) ni conocimientos especializados.
- El inicio de acción de las drogas administradas por esta vía debe ser rápido, lo más parecido posible a la vía intravenosa(29).
La vía transmucosa (fundamentalmente a través de la mucosa oral, sublingual y nasal) es la ruta que más se acerca a los requisitos expuestos anteriormente.
FENTANILO EN EL DOLOR IRRUPTIVO
En estos últimos años se han desarrollado una serie de formulaciones incluyendo como principio activo al fentanilo, que se adaptan específicamente a las características del dolor irruptivo y se acercan bastante a los requerimientos básicos de la medicación ideal para el tratamiento de este proceso.
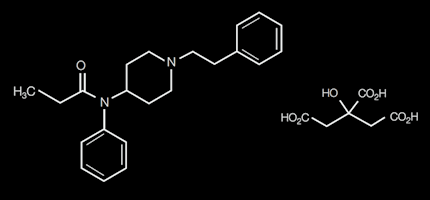
El fentanilo es un opioide sintético derivado de la fenilpiperidina. Su estructura química es similar a la de la peptidina30 y ha sido utilizado desde 1959.
Es un agonista puro µ con una potencia 100 veces superior a la de la morfina(31).
Debido a su alta liposolubilidad se distribuye ampliamente por los tejidos y tiene un rápido inicio de acción. Atraviesa más fácil y rápidamente la barrera hematoencefálica que la morfina lo cual explica su potente efecto analgésico y su baja incidencia de efectos secundarios centrales (náuseas y vómitos) y periféricos (estreñimiento) tan frecuentemente asociados con el uso de opioides. Se metaboliza predominantemente en el hígado y en el duodeno (aproximadamente la mitad del metabolismo hepático) en dos metabolitos inactivos, norfentanilo e hidrofentanilo que son eliminados por la orina.
La duración de la analgesia que proporciona es corta (30-60 min) después de su administración intravenosa. En contraste con la morfina no induce liberación de histamina.
Actualmente disponemos en el mercado de preparados de fentanilo que pueden ser administrados por diversas vías para el tratamiento del dolor crónico. Así tenemos parches que se usan por vía transdérmica (TD)(32), preparados a través de la mucosa oral y sublingual , la vía más reciente es a través de la mucosa nasal.
Debemos recordar que el fentanilo puede producir rigidez de la pared torácica(33)y por tanto los parches de fentanilo no están recomendados en pacientes con disnea que normalmente son tratados con morfina.
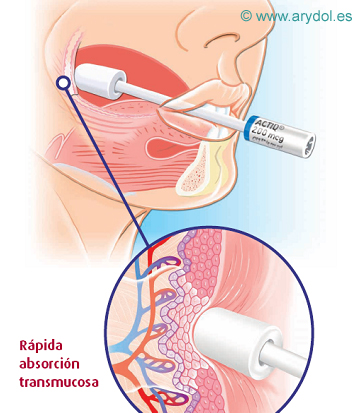
VÍA TRANSMUCOSA
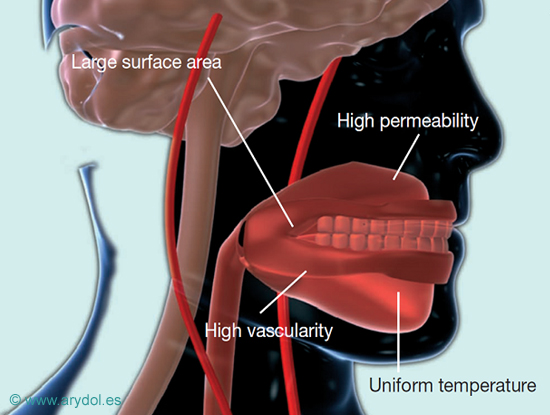
La cavidad oral tiene una buena capacidad de absorción de medicamentos; con una superficie total de aproximadamente 200 cm2 está altamente vascularizada, mantiene una temperatura uniforme y las drogas administradas por esta vía acceden a la circulación general a través de sus capilares.
Fig.8
Toda la superficie oral está cubierta por una capa de saliva que se segrega por las glándulas salivares. Una adecuada secreción es imprescindible no solo para disolver la droga administrada sino para mantener el pH de la cavidad oral(34). Un cambio en el pH afectaría a la fracción de fármaco ionizado y por tanto disminuiría su absorción.
Debido a la distinta composición de su epitelio la permeabilidad es diferente de unas zonas otras, así la mucosa sublingual es la de mayor permeabilidad, seguida de la mucosa bucal y las encías.
Hay una serie de factores que afectan la absorción(35):
- La liposolubilidad del fármaco.
- La fracción ionizada: el fentanilo es una base débil y por lo tanto altamente lipofílica, pero esta propiedad que facilita la absorción por la mucosa necesita para absorberse que previamente esté disuelto en la saliva(36) y para ello necesita un cierto grado de hidrofilia, es decir, un pH bajo, ácido, en el que domine la forma ionizada del fentanilo. Por el contrario, para absorberse requiere un pH alcalino en el que el fentanilo no esté ionizado para atravesar la barrera bucal.
- Tiempo de contacto del fármaco con la mucosa y potencia del mismo.
Fig. 9
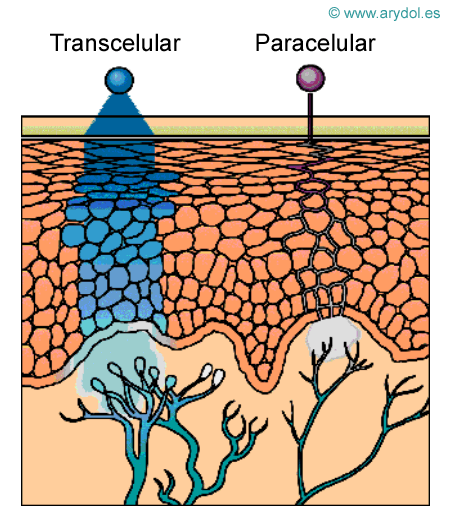
Mecanismos de Absorción de la Mucosa Oral
Transcelularmente se absorberían fármacos lipofílicos no ionizados como el fentanilo.
Paracelularmente se absorberían fármacos hidrofílicos ionizados como la morfina.
Ventajas de la vía oral transmucosa:
- No invasiva.
- Aceptada por pacientes y profesionales sanitarios.
- Puede ser usada en pacientes con disfagia y aquellos con nauseas y vómitos.
- La podemos utilizar en pacientes con alteraciones del tracto gastrointestinal superior.
- No requiere dispositivos específico (bombas de infusión, elastómeros) ni conocimientos especializados.
- La velocidad de inicio de la acción analgésica de las drogas administradas por esta vía es muy rápida, similar a la vía intravenosa.
Desventajas de la vía oral transmucosa:
- Esta vía no es adecuada para pacientes con sequedad o patología oral.
- Está sujeta a variaciones en la biodisponibilidad de la mucosa oral.
Los opioides aprobados para ser utilizados por esta vía son:
Citrato de fentanilo oral transmucosa:
El citrato de fentanilo de absorción oral transmucosa (CFOT) (Actiq®) fue el primer fármaco diseñado específicamente para el dolor irruptivo.
La unidad está constituida por una matriz sólida (comprimido edulcorado de fentanilo) que se disuelve en la boca, adherida a un bastoncillo aplicador de plástico. Esta forma de “chupa-chup” facilita su frotación por la mucosa de la boca y por tanto su absorción.
Fig. 10
El fármaco consta de dos capas diferentes de láminas de polímeros solubles en agua: una capa bio-adhesiva y otra capa inactiva. Mientras que la capa bio-adhesiva contiene citrato de fentanilo que se adhiere en cuestión de segundos tras entrar en contacto con la mucosa bucal húmeda, la inactiva aisla la capa bioadhesiva de la cavidad bucal, minimizando la cantidad de fentanilo que es ingerida(37, 38, 39), facilitando así la absorción directa través de la mucosa bucal.
Fig. 11
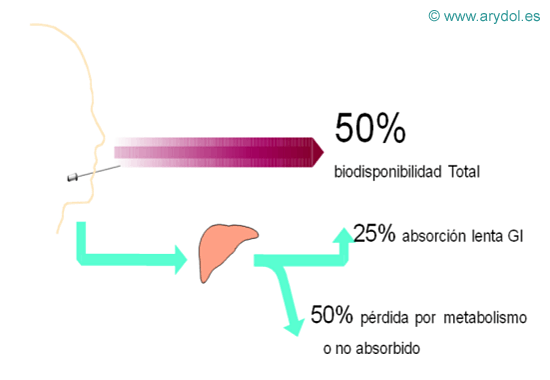
Aproximadamente un 25% del fentanilo disuelto se absorbe a través de la mucosa oral y es responsable del efecto terapéutico rápido, ya que traspasa la barrera hematoencefálica en 3-5 minutos.
Fig. 12
El fentanilo restante es deglutido y se absorbe parcialmente a nivel del estómago e intestino, tras pasar por el ciclo entero-hepático, siendo el responsable del efecto analgésico tardío.
Como ya hemos comentado anteriormente, la absorción por la vía transmucosa se realiza sólo en un 25%; el otro 75% restante pasa al tubo digestivo donde, a su vez, otro 25% es absorbido y llega al sistema nervioso central (40). Estamos consiguiendo una bidisponibilidad aproximada del 50 % (41). El resto de fentanilo no absorbido se elimina por la orina como principio activo o de metabolito inactivo(42).
Fig. 13
El efecto analgésico se inicia a los 5–10 minutos en el 80% de los pacientes, alcanza su máximo en 20-30 minutos y persiste aproximadamente durante 1–2 horas. Se comercializa en unidades de 200, 400, 600, 800,1200 y1600 µg. Hay que advertir a los pacientes de la posibilidad de aparición de efectos secundarios como sequedad de boca, náuseas, vómitos, somnolencia, estreñimiento, mareo, propios del tratamiento con opioides.
La potencia relativa del fentanilo de absorción bucal transmucosa con respecto a la morfina es 10:1
- 200 mcg ACTIQ® equivalen a 2 mg de morfina IV
- 800 mcg ACTIQ® equivalen a 8 mg de morfina IV
En relación a la morfina oral, la equivalencia puede estimarse en base a:
- 200 mcg ACTIQ® equivalen aprox. a 6 mg de morfina oral
- 800 mcg ACTIQ® equivalen aprox. a 24 mg de morfina oral
Reseñar que, aunque en un principio apareció como tratamiento del dolor irruptivo en la actualidad se está prescribiendo “off-label uses", es decir, no para los pacientes de cáncer, sino para el control del dolor postoperatorio, enfermos con lesiones óseas, migrañas, dolor de espalda severo, dolores de cabeza en racimo, neuropatías y otras situaciones de dolor crónico severo no maligno.
Citrato de fentanilo en comprimidos bucales:
Comercializado en España con la marca de Effentora®, esta formulación galénica ha intentado resolver el problema de la baja absorción añadiéndole ácido cítrico. Este disminuye el pH y aumenta la solubilidad del fentanilo, por lo que el fármaco puede atravesar la membrana y posteriormente facilitar la absorción, provocando la liberación de bicarbonato y de carbonato de sodio que aumenta el pH oral, alcalinizándolo. De esta forma el fentanilo en su forma no ionizada atraviesa la barrera celular alcanzando una biodisponibilidad del 65%, superior a la formulación anterior.
Citrato de fentanilo de absorción sublingual:
Para solucionar los problemas de absorción planteados por la formulación galénica transmucosa del citrato de fentanilo ha aparecido una nueva presentación de absorción sublingual(43) que pretende superar los problemas asociados con los opioides orales convencionales, en relación con el inicio y la duración de la acción.
La vía sublingual, ya utilizada para otros fármacos, evita el metabolismo de primer paso por las enzimas hepáticas lo que se traduce en una mayor biodisponibilidad.
Ventajas de la vía sublingual:
- Es altamente permeable por lo que hay una rápida absorción del fármaco desde la cavidad sublingual a la circulación sistémica.
- Aceptable y cómoda.
- Evita el metabolismo de primer paso por las enzimas del hígado (elevada biodisponibilidad).
- Mecanismo de desintegración y disolución.
En general, el ritmo y la cantidad de fármaco absorbido a través de la mucosa oral e intestinal dependen de sus propiedades fisiológicas, tales como el estado de la mucosa gástrica(44,45). Las principales ventajas de la administración de fentanilo por vía sublingual son su rápido inicio de acción y el hecho de evitar su paso por el intestino y/o el metabolismo en el hígado.
La nueva formulación de fentanilo en comprimidos sublinguales permite una rápida absorción del fármaco desde la cavidad sublingual a la circulación sistémica. Su tecnología llamada oravescente libera CO2 en la cavidad bucal que disminuye inicialmente el pH y facilita la solubilización y la entrada del fentanilo ionizado. Posteriormente se eleva el pH de la mucosa oral y ello permite el paso del fentanilo no ionizado a través de la barrera celular.
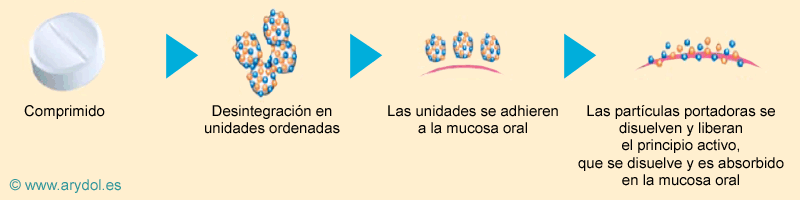
- Los comprimidos están compuestos por una mezcla ordenada de partículas portadoras solubles en agua (manitol) recubiertas con partículas del fármaco activo (citrato de fentanilo).
- Estas partículas ordenadas permiten:
- La retención y exposición óptima del fentanilo en la cavidad oral.
- La inmediata disolución del fármaco
A la fórmula se le añaden una serie de excipientes muy importantes para la farmacocinética del fármaco como la croscarmelosa sódica, un componente bioadhesivo que actúa desintegrando y reteniendo el fármaco activo en la mucosa oral. De esta forma se consigue una absorción rápida desde la mucosa oral hacia la circulación sistémica, ya que se evita el paso por el tracto gastrointestinal.
Fig. 14
Después del primer minuto ya se ha disuelto en la saliva más del 70% del producto , a partir de los 3 minutos se ha disuelto más del 95% de fntanilo y el 100% a partir de los 5 minutos. Esto es independiente de la dosis del fentanilo.
En cuanto el efecto analgésico en el 70% de los pacientes aparece en los 5 primeros minutos aunque el efecto máximo se consigue entre los 30 y los 60 minutos.
El fentanilo sublingual sólo debe ser administrado a aquellos pacientes que toleren su terapia de base con opioides. Puede considerarse que los pacientes son tolerantes a opioides (46) si están tomando:
- >= 60 mg al día de morfina oral.
- 25 µg/hora de fentanilo transdérmico.
- una dosis analgésica equivalente de otro opioide durante >= 1 semana.
Los comprimidos de FSL (Abstral®) están disponibles en seis concentraciones de dosis: 100, 200, 300, 400, 600 y 800 µg.
Fig. 15
Para administrar el FSL, se coloca un comprimido debajo de la lengua en la parte más profunda de la cavidad sublingual, donde se dejará que se disuelva por completo Si un paciente tiene la boca seca se recomienda que utilicen agua para humedecer la cavidad bucal antes de tomar FSL.
Masticar, chupar o tragar podría producir una menor absorción y bajas concentraciones plasmáticas de fentanilo.
Fig. 16 Comparación farmacocinética de las dos vías de administración. La mucosa bucal es menos permeable que la mucosa sublingual.
- No puede ofrecer la rápida absorción y elevada biodisponibilidad asociadas con la administración sublingual del fármaco (1).
- Tras la administración bucal, puede tragarse una gran proporción de fentanilo.
- La administración del CFOT requiere el contacto prolongado entre la pastilla y la mucosa.
- El fentanilo oral o sublingual presenta un pico plasmático que oscila entre los 10 (FTB) y los 15-30 minutos (CFOT).
- Las dosis equivalentes de fentanilo sublingual son la mitad que las de fentanilo transmucosa.
VÍA INTRANASAL
En los últimos años ha aparecido una nueva vía de administración del fentanilo ya utilizada para otros fármacos, la vía intranasal. Es una forma más de administración transmucosa que aporta ciertas ventajas sobre las anteriores.
En los adultos el volumen de la cavidad intranasal es de 15-20ml. y el área de superficie es 150-180 cm2 ; es pues una superficie relativamente grande, permeable y altamente vascularizada . Los factores que influyen en la absorción son de tipo anatomofisiológico, que ya se han comentado, y otros relacionados con las propiedades fisicoquímicas del fármaco que se administra(47). Los sistemas de administración influyen también sobre la distribución del fármaco dentro de la fosa nasal.
En la mucosa nasal se han encontrado enzimas (CYP2C, CYP3A y NADPH-reductasa) en cantidad suficiente como para desarrollar una actividad metabólica que podría ser equivalente casi a un efecto de primer paso hepático, aunque su repercusión clínica se desconoce. Las drogas a través de esta vía deben ser administradas en pequeñas cantidades para evitar el paso a la faringe. El volumen teórico máximo recomendado en humanos es de 150 µl por fosa, aunque la distribución de este volumen dependerá de varios factores, como es el sistema de administración y la posición de la cabeza. Una parte del fármaco administrado puede pasar como ya hemos dicho a la faringe, donde puede absorberse por vía enteral, y esto debe de tenerse en cuenta en la posología y debe de evaluarse mediante estudios farmacocinéticos.
Fármacos lipofílicos como el fentanilo son absorbidos rápida y efectivamente, desde la mucosa nasal al torrente sanguíneo(48), evitando el efecto de primer paso en el hígado.
A los 13 minutos de la administración obtenemos la concentración máxima plasmática, siendo la biodisponibilidad del 70-90%.
Fig. 17
El fentanilo intranasal del que disponemos en España utiliza la tecnología patentada PecSys.
Mediante esta tecnología se libera en la cavidad nasal un fino aerosol de gotículas (de igual tamaño) de fentanilo, en una solución acuosa de baja viscosidad con pectina. Las cadenas de pectina y los iones calcio presentes en las secreciones nasales interaccionan formando una matriz de gel a partir de la cual se absorbe el fentanilo al torrente sanguíneo.
La pectina no se metaboliza y no se absorbe, debido a su gran tamaño molecular, hasta que llega al intestino grueso en donde es digerida por la microflora del colon (la pectina es componente habitual de la dieta humana).
Esto permite un inicio de a acción analgésica y una absorción contralada del fármaco.
Ventajas de la vía intranasal:
- Vía de administración no invasiva con alta aceptación por parte de paciente y su familia.
- Se evitan algunas de las complicaciones de la administración oral:náuseas-vómitos, mucosa oral seca o ulcerada, mucositis, etc.
- El spray no gotea ni se deglute: inconveniente habitual de otras soluciones intranasales convencionales.
- La absorción del fentanilo se optimiza: absorción rápida y controlada mimetizando la analgesia a las características y duración del episodio de dolor irruptivo oncológico.
Fig. 18
En España contamos con dos presentaciones de 100 y 400 µg por spray
- Cada unidad administra 8 sprays de fentanilo, proporcionando como mínimo un día de tratamiento a dosis máxima.
- La dosis administrada es controlada con precisión mediante contador visual y auditivo de dosis; bloqueo a la finalización de los 8 sprays. Ésto simplifica la administración intranasal del producto y favorece el cumplimiento del tratamiento.
Varios estudios(49, 50, 51) se han publicado sobre la eficacia y seguridad de la utilización del fentanilo intranasal en el tratamiento del dolor postoperatorio en adultos, como en el dolor tras cirugía ortopédica (cirugía discal y cirugía abdominal y tiroidea tanto en población adulta(52) como en niños(53). Los efectos adversos sistémicos son similares a los descritos para los opioides y otros, específicos de esta vía de administración, como picor local, estornudos, sequedad, alteración del gusto, epistaxis(54).
¿QUÉ PAUTA ANALGÉSICA DEBEMOS SEGUIR ANTE LA APARICIÓN DE DOLOR IRRUPTIVO?
Antes de utilizar fentanilo en transmucosa se presupone que el dolor de fondo está controlado y que, en general el paciente no presenta más de 4 episodios de dolor irruptivo/día. No existe una clara relación entre la dosis basal de opioides y la dosis necesaria para el tratamiento de rescate.
Si el dolor no se controla con la primera dosis de fármaco que administremos para el dolor irruptivo , se puede repetir a los 15-30 minutos de haber finalizado la administración del anterior; pero en general no se recomienda administrar más de 2 dosis por episodio de dolor ni más de 4 comprimidos al día. Cuando se usan dos dosis en un episodio, la siguiente vez se debería empezar con una dosis mayor equivalente.
OTROS FÁRMACOS
Para los pacientes que estén en tratamiento con buprenorfina transdérmica y a los que se quiera dar una dosis extra, existen comprimidos de buprenorfina que pueden ser administrados por vía sublingual. Sin embargo, hay muchas razones para no recomendar este fármaco en el tratamiento del dolor irruptivo. Por un lado, la buprenorfina es un agonista parcial de receptores mu e incluso antagonista de receptores kappa. Además, no se conoce bien la biodisponibilidad de los comprimidos de buprenorfina sublingual, (se estima entre el 15% y el 30%), y su pico de concentración plasmática se alcanza a los 90 minutos. La dosis recomendada como analgésico es 1-2 comprimidos de 0.2 mg cada 6-8 horas.
Debemos recordar que existen algunas drogas no opioides que pueden ser consideradas, sobre todo en pacientes con tolerancia a los opioides. Tal es el caso de la ketamina, que puede ser administrada incluso por vía nasal, pero siempre en casos refractarios y por médicos expertos.
Finalmente, merece la pena recordar que dentro del contexto de “dolor total”, existen otra serie de actuaciones que pueden ayudar a manejar un episodio de dolor irruptivo. Así por ejemplo, muchos pacientes aprenden a reconocer “posiciones antiálgicas” en las que mejora el dolor, sobre todo de origen musculoesquelético. El empleo de bifosfonatos retrasa la aparición de complicaciones óseas en algunos tumores. Otros pacientes reconocen que la aplicación de calor o frío, o los masajes en la zona de dolor referido alivian la sintomatología. Las técnicas de relajación pueden hacer más soportable el tiempo de espera hasta que aparece el efecto de la medicación, y la utilización de medicación coadyuvante (corticoides, ansiolíticos, antidepresivos, neuromoduladores, etc., deben ser tenidos siempre en cuenta.
MANEJO NO FARMACOLÓGICO
Las intervenciones no farmacológicas proporcionan opciones sencillas y rentables que generalmente están desprovistas de efectos secundarios e interacciones fármaco-fármaco.
Entre las opciones no farmacológicas se encuentran:
- Limitación de actividades.
- Hielo.
- Calor.
- Corsés y vendajes.
- Cremas contra-irritantes.
- Técnicas de medicina física (masaje, TENS, bloqueos nerviosos). Educación del paciente.
Siempre que sea posible deberán integrarse las intervenciones no farmacológicas con la terapia farmacológica para ayudar a aliviar la carga del DI oncológico.
BIBLIOGRAFÍA
- Portenoy R, Hagen N. Breakthrogh pain: definition, prevalence and characteristics. Pain 1990; 41: 273-81.
- Velazquez I. Definición, clasificación y epidemología. En Dolor Irruptivo. XIX Reunión de la Asociación Andaluza del Dolor.2010;6-8.
- Mesrkey H, Bogduk N. Clasification of chronic pain, second edition .IASP Press.Seatle.1994; 219-214.
- Ferrell BR, Virani R. Paice JA. Malloy P. Dahlin C. Statewide efforts to improve palliative care in critical care settings. Crit Care Nurse. 2010 Dec; 30(6):40-5.
- Portenoy RK. Forbes K. Lussier D. Difficult pain problems an integrated approach. En Doyle D. Hanks G. Cherny N. Kalman K. Oxford Textbook of Palliative Madicine third edition Oxford University Press.2004; 438-458.
- Zepetella G., Odoherty CA, Collins S., Prevalence and Characteristics of brakhrough pain in patients with non malignant terminal disease admitted to a hospice. Palliative medicine.2001; 15:243-246.
- Portenoy RK. Payne D. Jacobssen P.Breakthrough pain characteristics and impact in patients with cancer pain.Pain 1999; 81:129-134.
- Davies A. Introduction. En Davies A. Cancer-related breakthrough pain revised edition.2009; 1-9.
- Gómez-Batiste X, Madrid F, Moreno F, Gracia A, Trelis J, Nabal M, Alcalde R, Planas J, Camell H. Breakthrough cancer pain: prevalence and characteristics in patients in Catalonia, Spain. J Pain Symptom Manage. 2002 Jul; 24(1):45-52.
- Fortner BV, Demarco G, Irving G, Ashley J, Keppler G, Chavez J, Munk J. Description and predictors of direct and indirect costs of pain reported by cancer patients. J Pain Symptom Manage. 2003 Jan; 25(1):9-18.
- Davies A, Zeppetella G, Andersen S, Damkier A et al. Multi-centre European study of breakthrough cancer pain
- Portenoy RK.Managing cancer pain poorly responsive to systemic opioid therapy. Oncology. 1999 May; 13(5 Suppl 2):25-9.
- Davies AN, Dickman A, Reid C, Stevens AM, Zeppetella G. The management of cancer-related breakthrough pain: Recommendations of a Task Group of the Science Committee of the Association for Palliative Medicine of Great Britain and Ireland. Eur J Pain. 2009; 13: 331–33
- Hui D, Bruera E. Breakthrough pain in cancer patients: The need for evidence. Eur J Palliat Care.2010; 17: 58–67
- Leppert W.Role of intranasal fentanyl in breakthrough pain management in cancer patients. Cancer Manag Res. 2010 Sep 30; 2: 225-32.
- Davies A. Introduction. En Davies A. Cancer-related breakthrough pain revised edition.2009; 1-9.
- Mercadante S, Radbruch L, Caraceni A, Cherny N, Kaasa S, Nauck F, et al, Steering Committee of the European Association for Palliative Care (EAPC) Research Network. Episodic (breakthrough) pain: consensus conference of an expert working group of the European Association for Palliative Care. Cancer 2002; 94:832-9.
- Galvez R. Etiología e impacto en los pacientes. Dolor Irruptivo. XIX Reunión de la Asociacion Andaluza del Dolor. 2010;9-11
- Labrecque G, Vanier MC. Biological rhythms in pain and in the effects of opioid analgesics. Pharmacol Ther. 1995; 68 (1):129-47.
- Coluzzi PH. Cancer pain management: newer perspectives on opioids and episodic pain. Am J Hosp Palliat Care. 1998 Jan-Feb;15(1):13-22.
- Coluzzi PH, Schwartzberg L, Conroy JD, Charapata S, Gay M, Busch MA, Chavez J, Ashley J, Lebo D, McCracken M, Portenoy RK. Breakthrough cancer pain: a randomized trial comparing oral transmucosal fentanyl citrate (OTFC) and morphine sulfate immediate release (MSIR).Pain. 2001 Mar; 91(1-2):123-30.
- Hwang SS, Chang VT Kasimis B.Cancer breakthrough pain characteristics and responses to treatment at a VA medical center. Pain. 2003 Jan; 101(1-2):55-64
- Dickman A. Integrated strategies for the successful management of breakthrough cancer pain. Curr Opin Support Palliat Care. 2011 Mar;5(1):8-14.
- Portenoy RK and Hagen NA. Pain 1990; 41(3):273–281.
- World Health Organization. Cancer Pain Relief (2nd edn) World Health Organization.1996. Geneva.
- Hanks GW, de Conno F, Cherny N, et al. Expert Working Group of the Research Network of the European Association for Palliative Care Morphine and alternative opioids in cancer pain: The EAPC recommendations. Br J Cancer. 2001; 84: 587–593.
- Patt RB, Ellison NM. Breakthrough pain in cancer patients: characteristics, prevalence, and treatment. Oncology (Williston Park). 1998 Jul;12(7):1035-46; discussion 1049-52.
- Walker G, Wilcock A, Manderson C, Weller R, Crosby V. The acceptability of different routes of administration of analgesia for breakthrough pain.
Palliat Med. 2003 Mar; 17(2):219-21. - Zhang H, Zhang J, Streisand JB.Oral mucosal drug delivery: clinical pharmacokinetics and therapeutic applications.Clin Pharmacokinet. 2002; 41(9):661-80.
- Moser KM. Transdermal fentanyl in cáncer-related pain. Amm Fam. Phys. 1992; 45: 2289-2294.
- Prommer E. The role of fentanyl in cáncer-related pain. Journal of Palliative Medicine.2009; 12:947-954.
- Ahmedzai S, Brooks. Transdermal fentanyl versus sustained-release oral morphine in cancer pain: preference, efficacy, and quality of life. J Pain Symptom Manage. 1998 Sep; 16(3):141-4.
- Zylicz Z, van Rijn-van der Plaat LL. Fentanyl may increase breathlessness in a patient with motor neuron disease. J Pain Symptom Manage. 2006 Sep;32(3):199-200.
- Hao J, Heng PW. Buccal delivery systems. Drug Dev Ind Pharm. 2003 Sep;29(8):821-32.
- Zhang H, Zhang J, Streisand JB.Oral mucosal drug delivery: clinical pharmacokinetics and therapeutic applications. Clin Pharmacokinet. 2002;41(9):661-80.
- Shojaei AH.Buccal mucosa as a route for systemic drug delivery: a review.J Pharm Pharm Sci. 1998 Jan-Apr;1(1):15-30.
- Vasisht N, Gever LN, Tagarro I, Finn AL. Evaluation of the single- and multiple-dose pharmacokinetics of fentanyl buccal soluble film in normal healthy volunteers. J Clin Pharmacol.2010;50: 785–791.
- Vasisht N, Gever LN, Tagarro I, Finn AL. Formulation selection and pharmacokinetic comparison of fentanyl buccal soluble film with oral transmucosal fentanyl citrate. Clin Drug Investig.2009; 29:647–654.
- Vasisht N, Gever LN, Tagarro I, Finn AL. Single-dose pharmacokinetics of fentanyl buccal soluble film. Pain Med. 2010;11: 1017–1023.
- Delgado-Guay MO.Efficacy and safety of fentanyl buccal for cancer pain management by administration through a soluble film: an update. Cancer Manag Res. 2010 Nov 24;2: 303-6.
- Streisand JB, Busch MA, Egan TD, Smith BG, Gay M, Pace NL.Dose proportionality and pharmacokinetics of oral transmucosal fentanyl citrate.Anesthesiology. 1998 Feb; 88(2):305-9.
- Streisand JB, Varvel JR, Stanski DR, Le Maire L, Ashburn MA, Hague BI, Tarver SD, Stanley T. Absorption and bioavailability of oral transmucosal fentanyl citrate. Anesthesiology. 1991 Aug;75(2):223-9.
- Bredenberg S, Duberg M, Lennernäs B, Lennernäs H, Pettersson A, Westerberg M, Nyström C. In vitro and in vivo evaluation of a new sublingual tablet system for rapid oromucosal absorption using fentanyl citrate as the active substance. Eur J Pharm Sci. 2003 Nov;20(3):327
- Lennernäs B, Hedner T, Holmberg M, Bredenberg S, Nyström C, Lennernäs H. Pharmacokinetics and tolerability of different doses of fentanyl following sublingual administration of a rapidly dissolving tablet to cancer patients: a new approach to treatment of incident pain. Br J Clin Pharmacol. 2005 Feb;59(2):249-53.
- Zhang H, Zhang J, Streisand JB. Oral mucosal delivery: clinical pharmacokinetics and therapeutic applications. Clin Pharmacokin 2002; 41: 661–80.8
- Lennernäs B, Frank-Lissbrant I, Lennernäs H, Kälkner KM, Derrick R, Howell J. Sublingual administration of fentanyl to cancer patients is an effective treatment for breakthrough pain: results from a randomized phase II study. Palliat Med. 2010 Apr;24(3):286-93.
- Mygind N, Vesterhauge S. aerosol distribution in the nose. rhinology 1978; 16:79-88.
- Foster D, Upton R, Christrup L, Popper L. Pharmacokinetics and pharmacodynamics of intranasal versus intravenous fentanyl in patients with pain after oral surgery. Ann Pharmacother. 2008 Oct;42(10):1380-7. Epub 2008 Aug 26.
- Triebel HW, Pommering J, Rieger A. Intranasal fentanyl titration for postoperative pain management in an unselected population. Anaesthesia 1993; 48:753-757.
- Striebel HW, Olmann T, Spies C, Brummer G. Patient-controlled intranasal analgesia (pcna) for the management of postoperative pain: a pilot study. j clin anesth 1996; 8:4-8.
- Striebel HW, Oelmann T, Spies C, Rieger A, Schwagmeier R. Patient-controlled intranasal analgesia: a method for noninvasive postoperative pain management. anesth analg 1996; 83:548-551.
- Toussaint S, Maidl J, Schwagmeier R, Striebel HW Patient-controlled intranasal analgesia: effective alternative to intravenous PCA for postoperative pain relief.Can J Anaesth. 2000 Apr;47(4):299-302.
- Galinkin JL, Fazi LM, Cuy RM, Chiavacci RM, Kurth CD, Shah UK, Jacobs IN, Watcha MF.Use of intranasal fentanyl in children undergoing myringotomy and tube placement during halothane and sevoflurane anesthesia. Anesthesiology. 2000 Dec;93(6):1378-83.
- Radbruch L, Torres LM, Ellershaw JE, Gatti A, Luis Lerzo G, Revnic J, Taylor D.Long-term tolerability, efficacy and acceptability of fentanyl pectin nasal spray for breakthrough cancer pain. Support Care Cancer. 2011 Mar 22.