ANATOMÍA DE LAS MENINGES ESPINALES HUMANAS
Miguel Angel Reina - Hospital Universitario Madrid Montepríncipe.
José Antonio de Andrés - Hospital Universitario General de Valencia.
Alberto Prats - Departamento de Anatomía y Embriología. Facultad de Medicina. Universidad de Barcelona.
1. INTRODUCCIÓN
Las meninges espinales rodean la médula espinal y las raíces nerviosas contenidas dentro del conducto raquídeo. La duramadre es la hoja más externa, la piamadre es la hoja más interna, y la aracnoides se dispone entre ambas. Las meninges limitan los espacios epidural, subdural y subaracnoideo.
2. ESPACIO EPIDURAL
El espacio epidural es un compartimiento con forma de corona circular, no uniforme, limitado por fuera, por el periostio del conducto vertebral y el ligamento amarillo; y por dentro, por el saco dural. Se extiende desde el agujero occipital (foramen magnun) hasta el extremo inferior del conducto del sacro. En la región craneal, la duramadre se adhiere al periostio del foramen magnum. En la región caudal, el espacio epidural se prolonga por debajo del fondo del saco dural hasta el hiato sacro. El conducto vertebral está limitado por delante, por el ligamento longitudinal posterior, que recubre los cuerpos vertebrales y los discos intervertebrales[1-2]. Este ligamento separa el espacio epidural anterior del plexo vertebral anterior del que se originan las venas basivertebrales que penetran en los cuerpos vertebrales.
Lateralmente, el espacio epidural está limitado por los pedículos vertebrales que forman los forámenes intervertebrales, y posteriormente, por las láminas vertebrales y por el ligamento amarillo, en la zona de los forámenes interlaminares. El ligamento amarillo tiene una porción derecha e izquierda, que se unen dejando, en algunos casos, defectos de fusión, en forma de espacios cerrados en el espesor del ligamento[3] (Figura 1).
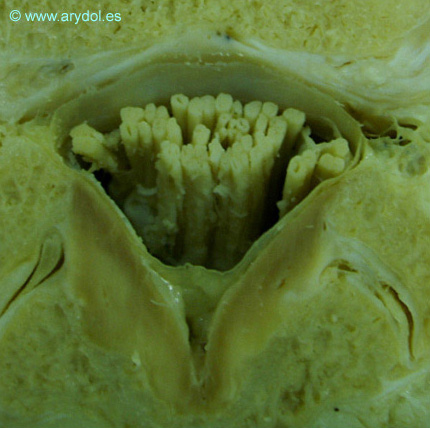
Corte transversal del conducto raquídeo humano en la región lumbar.
En el espacio epidural posterior, Blomberg[4] (1986) describió la "plica dorsalis medianalis” como una estructura fibrosa longitudinal, pero discontinua en la línea medio-sagital a lo largo del espacio epidural posterior, en especial en la región lumbar. No obstante, esta estructura no fue encontrada en los cortes por congelación realizados por Hogan[5-6].
El espacio epidural tiene zonas con un espacio real ocupado por grasa, venas y nervios, y otras zonas, con un espacio virtual donde el saco dural está apoyado sobre los cuerpos vertebrales, los pedículos vertebrales, las láminas y el ligamento amarillo[7-9]. La parte virtual del espacio epidural se puede convertir en un espacio real cuando se inyectan soluciones o aire. La grasa epidural forma el mayor componente de ese espacio real.
Los paquetes de grasa epidural lumbar tienen una topografía metamérica, discontinua y está localizada, principalmente, en la parte posterior del espacio epidural[7-8]. El bloque de grasa en un corte axial tiene forma triangular. La grasa epidural llega lateralmente hasta la unión con las facetas articulares. Se ubica entre los arcos vertebrales y se prolonga por los laterales hasta los forámenes intervertebrales rodeando a las raíces nerviosas en la zona de los manguitos durales[7-8]. Estos paquetes de grasa epidural están adheridos a la línea media posterior por un pedículo vascular.
La grasa epidural tiene una distribución variable a lo largo de la columna vertebral, pero característica en cada nivel vertebral. A nivel cervical, está ausente. A nivel torácico, está formada por una banda posterior con aspecto “dentado”. En la zona torácica alta-media (T1-7) es continua y con una imagen dentada, mientras que en la zona torácica baja (T8-12) se hace discontinua[7-8]. A nivel lumbar, la grasa del espacio epidural anterior y posterior se observa de forma independiente. La grasa epidural posterior adquiere su mayor volumen próximo a los discos de L3-4 y L4-5. En el conducto del sacro la grasa epidural alcanza su mayor desarrollo.
3. SACO DURAL
El saco dural (Figura 2 y 3) se prolonga hasta la segunda vértebra lumbar, y más caudal, se prolonga como un cordón fibroso (filum terminal) que termina por insertarse en la cara dorsal del cóccix, como ligamento coxígeo.
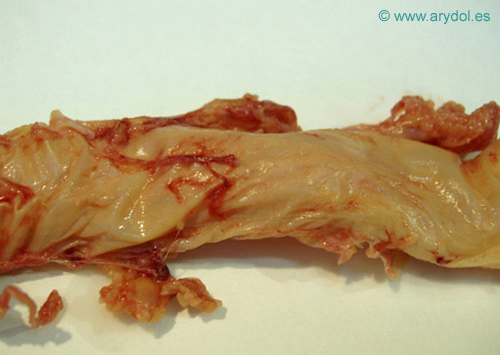
Saco dural humano.
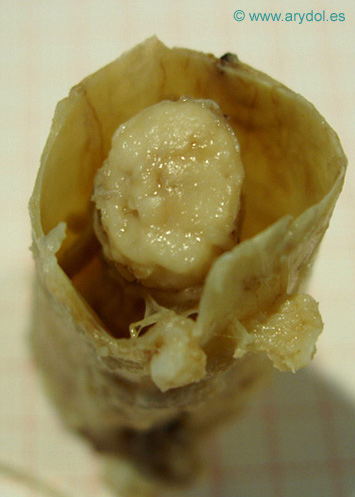
Corte transversal del saco dural humano. En su interior se observa la médula espinal.
El saco dural está anclado al conducto vertebral en toda su extensión por formaciones fibrosas que cruzan el espacio epidural[10-11]. Está formado principalmente por la duramadre que ocupa el 90% externo[12-14]. La duramadre es una estructura fibrosa y permeable que aporta resistencia mecánica. El 10 % interno del saco dural corresponde a la lámina aracnoidea, una lámina celular con escasa resistencia mecánica. Esta lámina es semipermeable a las sustancias y es la estructura que controla el paso de sustancias a través del saco dural[12].
4. DURAMADRE
La duramadre está constituida por aproximadamente 80 láminas durales concéntricas, con un espesor de 5 µm de espesor cada una (Figura 4).

Espesor completo del saco dural humano. Corte longitudinal. A la derecha se separa la lámina aracnoidea. Microscopía electrónica de barrido. Aumento 300x. Publicado en Regional Anesthesia. 1997;22:161-166. Con permiso.
Cada lámina dural está formada, a su vez, por subunidades de finas láminas, aproximadamente entre 8 y 12 subunidades[15-16]. Las fibras de colágeno de la duramadre poseen diferentes orientaciones en las diferentes subunidades que forman cada lámina dural, auque siempre se mantienen dentro del plano concéntrico de cada lámina dural[17-18]. Estas fibras no se entrecruzan entre las diferentes láminas durales. En menor proporción se encuentran fibras elásticas. A diferencia de las descripciones clásicas, las fibras de colágeno no tienen una dirección longitudinal y paralela al eje de la columna vertebral. Las fibras se entrecruzan entre sí y pueden adoptar una dirección longitudinal, oblicua o transversal[17-18]. Cuando se realiza una punción lumbar, la punta de la aguja se encontraría con una malla fibrilar similar a la figura 5 antes de atravesar el saco dural.
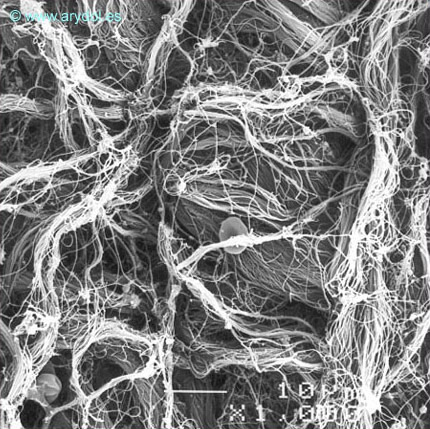
Fibras de colágeno en la lámina dural más externa. Microscopía electrónica de barrido. Aumento 1.000x. Publicado en Revista Española de Anestesiología y Reanimación. 1996;43:130-134. Con permiso.
5. LÁMINA ARACNOIDEA
La aracnoides es una fina membrana que forma parte del espesor del saco dural en su porción más interna. Esta lámina aracnoidea tendría un efecto barrera al ser una membrana semipermeable. Su espesor sería de 35 a 40 µm (Figura 6) y estaría formado por células unidas fuertemente entre sí por uniones específicas de membrana[12].
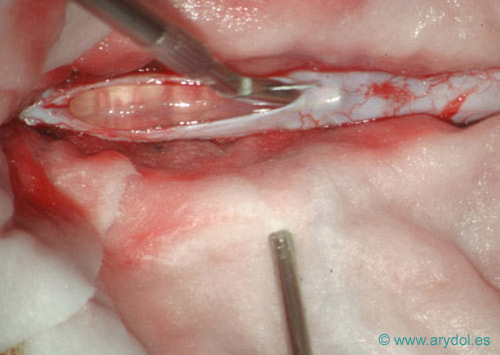
Disección de la lámina aracnoidea. Cortada la duramadre, se observa la lámina aracnoidea como una membrana transparente. Publicado en Revista Argentina de Anestesiología. 2007; 65:167-184. Con permiso.
Entre estas células no hay colágeno, sólo un estrecho espacio ocupado por sustancia amorfa.
6. ARACNOIDES TRABECULAR
La aracnoides trabecular es una estructura laxa con aspecto de tela de araña formada por fibras de colágeno recubiertas por células aracnoideas.
El trabeculado aracnoideo se extiende desde la lámina aracnoidea hasta la piamadre de la médula, y de las raíces nerviosas. Este trabeculado envía proyecciones que rodean a todas las estructuras que se encuentran en el espacio subaracnoideo, incluyendo vasos y nervios de diferente diámetro[19-20]. Las raíces nerviosas no están libres dentro del espacio subaracnoideo, sino rodeadas por estructuras tubulares pertenecientes al trabeculado aracnoideo, denominadas fundas aracnoideas[21-22] (Figuras 7 y 8). El espesor de estas fundas es variable, entre 10 y 60 µm22.
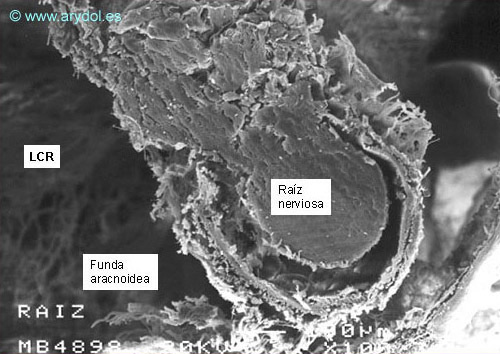
Trabeculado aracnoideo humano alrededor de una raíz nerviosa de la cola de caballo. Microscopía electrónica de barrido. Aumento 100x. Publicado en Revista Española de Anestesiología y Reanimación. 1999;46:99-105. Con permiso.
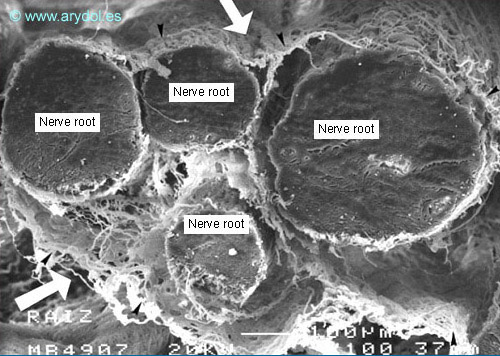
Aracnoides trabecular humana. Cuatro raíces nerviosas rodeadas por la aracnoides trabecular. Microscopía electrónica de barrido. Aumento: 100x. Barra: 100 µm. Publicado en Revista Española de Anestesiología y Reanimación. 1999; 46:99-105. Con permiso.
7. PIAMADRE
La piamadre está constituida por un plano celular formado por células piales (Figuras 9 y 10), y por un compartimiento subpial[19,23-24] con fibras de colágeno, sustancia amorfa, fibroblastos, escasos macrófagos, algunas arterias y venas.
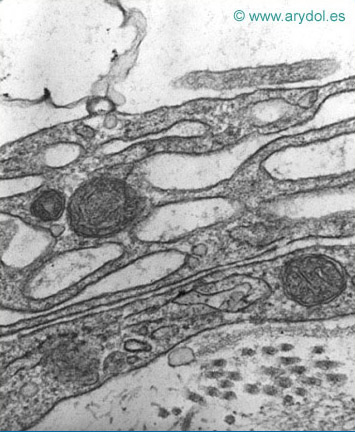
Piamadre humana. Varios planos celulares estratificados sobre una raíz nerviosa. Se observan mitocondrias y vacuolas en el citoplasma. Microscopía electrónica de transmisión. Aumento: 50.000x. Revista Argentina de Anestesiología. 2008;66:111-133. Con permiso.
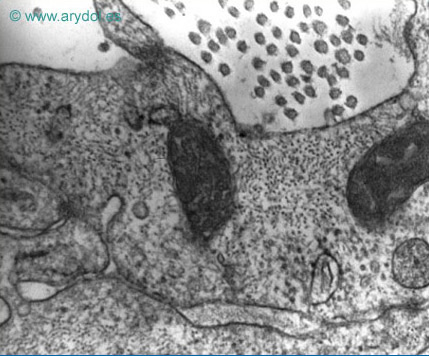
Piamadre humana. Detalle de la unión especializada de membrana entre dos células piales. Microscopía electrónica de transmisión. Aumento: 50.000x. Revista Argentina de Anestesiología. 2008;66:111-133. Con permiso.
En la superficie de la piamadre se pueden encontrar perforaciones naturales en la zona del cono medular (Figuras 11 y 12).
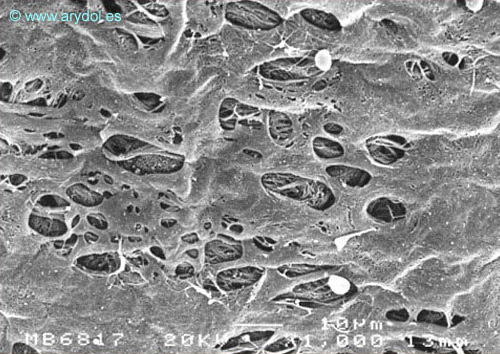
Fenestraciones en la piamadre humana del cono medular espinal. Microscopía electrónica de barrido. Aumento 1.000x. Publicado en Revista Española de Anestesiología y Reanimación. 1998;45:4-7. Con permiso.
Fenestraciones en la piamadre humana del cono medular espinal. Microscopía electrónica de barrido. Aumento 4.500x. Publicado en Revista Española de Anestesiología y Reanimación. 1998;45:4-7. Con permiso.
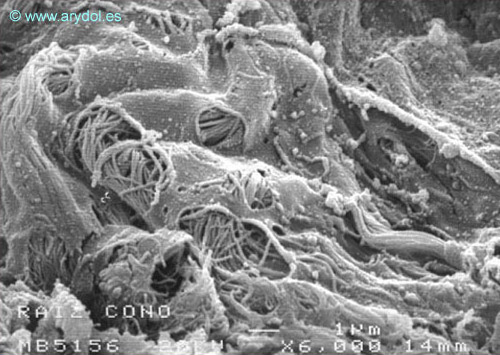
Así como en las raíces de la cola de caballo[23-24] (Figuras 13 y 14).

Perforaciones en la piamadre humana de las raíces nerviosas. Microscopía electrónica de barrido. Aumento: 500x. Revista Argentina de Anestesiología. 2008;66:111-133. Con permiso.
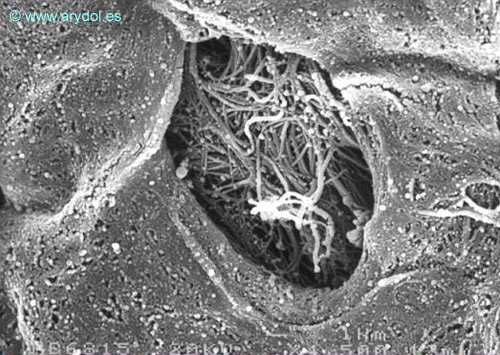
Perforaciones en la piamadre humana de las raíces nerviosas. Microscopía electrónica de barrido. Aumento: 6.000x. Revista Argentina de Anestesiología. 2008;66:111-133. Con permiso.
8. MANGUITOS DURALES
La prolongación del saco dural dentro del espacio epidural lateral da lugar a los manguitos durales. Éstos están formados por una prolongación de la duramadre y un tejido de transición derivado de la prolongación de la lámina aracnoidea y de la piamadre[25-26]. En la zona de los manguitos durales, especialmente en la parte posterior, la duramadre es más delgada, mide alrededor de 80 µm de espesor. No obstante, este menor espesor no modificaría la permeabilidad en esta zona, que está controlada por el tejido de transición[25], antes mencionado.
Cuando observamos en la columna vertebral, la salida de los nervios raquídeos, la terminación de los manguitos durales ocupa diferentes posiciones con relación al agujero intervertebral, en sus distintos niveles de la columna. En la región cervical, esta terminación está dentro de las estrías del agujero; en la región torácica está relacionada con la cara interna del agujero, y en la región lumbar y sacra, se encuentran, por entero, dentro del conducto vertebral.
El componente fibrilar ocupa la porción externa de los manguitos durales. Esta estructura es una prolongación de la duramadre del saco dural, aunque con presencia de células adiposas[25,26] que separan las láminas durales (Figuras 15 y 16).
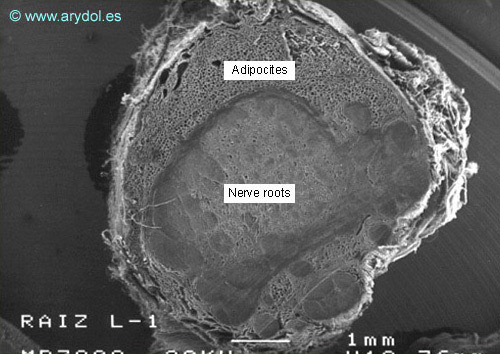
Manguito dural humano. Corte transversal. Microscopía electrónica de barrido. Aumento 12x. Publicado en Anesthesia & Analgesia. 2008;106:339-344. Con permiso.
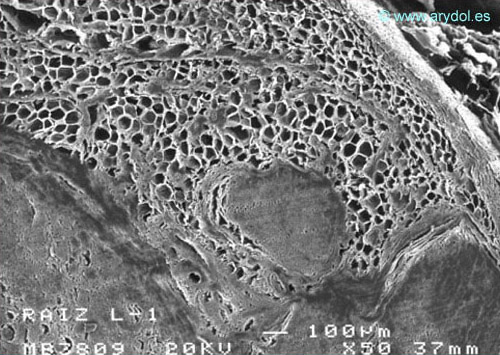
Manguito dural humano. Detalle de un corte transversal. Microscopía electrónica de barrido. Aumento 50x. Publicado Revista Española de Anestesiología y Reanimación. 2007;54:169-172. Con permiso.
Los adipocitos son una estructura propia de los manguitos durales y no se encuentran en el espesor del saco dural.
9. ESPACIO SUBDURAL
Entre la duramadre y la lámina aracnoidea no existe un espacio como se ha descrito clásicamente. El espacio subdural no es un espacio anatómico real. En su lugar hay un tejido formado por células neuroteliales. Son células alargadas, fusiformes, con extensiones ramificadas y poco adherentes entre sí 27-28 (Figura 17).
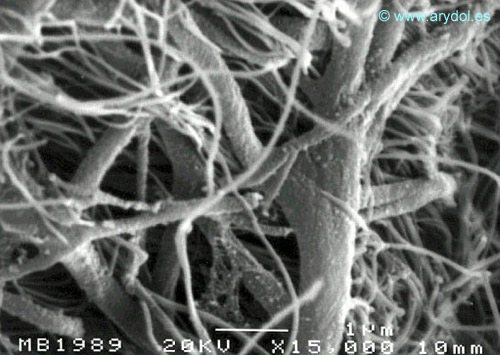
Células neuroteliales humanas en el compartimento subdural. Microscopía electrónica de barrido. Aumento 15.000x. Publicado en Revista Española de Anestesiología y Reanimación. 1998;45:367-376. Con permiso.
El compartimiento subdural estaría por tanto constituido por células neuroteliales localizadas entre la lámina dural más interna y la lámina aracnoidea27. Cuando concurren fuerzas de tracción en este compartimiento, las células neuroteliales se rompen y fragmentan, formándose un espacio, el espacio subdural (Figura 18).
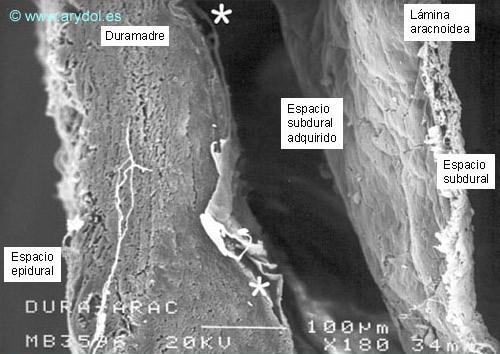
Espacio subdural humano adquirido. Esp Sub: espacio subaracnoideo, * espacios subdurales concéntricos secundários. Microscopía electrónica de barrido. Aumento 180x. Publicado en Revista Española de Anestesiología y Reanimación. 1998;45:367-376. Con permiso.
El espacio subdural no es un espacio virtual, sino un espacio adquirido durante la disección o la inyección de un fluido dentro de su espesor (Figura 19).
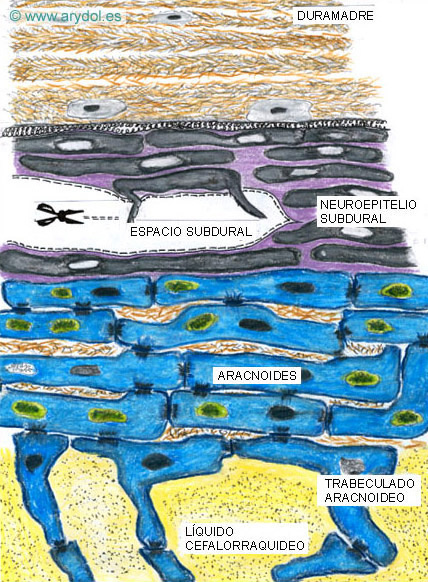
Esquema que representa el origen del espacio subdural espinal. Publicado en Revista Argentina de Anestesiología. 2007; 65:167-184. Con permiso.
10. VENAS EPIDURALES
Los principales plexos venosos del espacio epidural son dos: los plexos longitudinal anterior y posterior. Estas venas son suficientemente laterales para que una punción lumbar realizada por el plano sagital, no las lesione. Estos plexos longitudinales se unen por delante, por detrás y lateralmente a través de plexos transversos. Las venas del plexo transverso posterior, que son las más vulnerables, se encuentran situadas en la región dorsolumbar próximas a las láminas vertebrales y a cierta distancia de los ligamentos amarillos. Los plexos venosos vertebrales internos, que drenan la médula espinal y el conducto vertebral, se localizan principalmente en la zona anterolateral del espacio epidural.
Las venas epidurales, carentes de válvulas, por efecto de la presión venosa se distienden y disminuyen el volumen efectivo del espacio epidural, y por ello las soluciones epidurales tienden a distribuirse con una extensión craneal mayor de lo habitual cuando la inyección de una solución coincide con tos o una convulsión.
11. BIBLIOGRAFÍA
- Reina MA, De Andrés JA, López García A. Anatomía. Implicación en la práctica de las técnicas de conducción espinal. En: Torres LM Ed. Tratado de Anestesia, Reanimación y Tratamiento del Dolor. Madrid: Aran Ed; 2001. Tomo I. p.1135-55.
- Reina MA, De Andrés JA, Prats A. El saco dural en la anestesia neuroaxial. En: Aldrete JA, editor. Texto de Anestesiología. 3º edición. Mexico, Editorial Alfil; 2010 “en prensa”.
- Lirk P, Moriggl B, Colvin J, Keller C, Kirchmair L, Rieder J, Kolbitsch C. The Incidence of Lumbar Ligamentum Flavum Midline Gaps. Anesth Analg. 2004;98:1178-1180.
- Blomberg R. The dorsomedian connective tissue band in the lumbar epidural space of humans: an anatomical study using epiduroscopy in autopsy cases. Anesth Analg. 1986;65:747-752.
- Hogan QH. Lumbar epidural anatomy. A new look by cryomicrotome section. Anesthesiology 1991;75:767-775.
- Hogan Q. Epidural anatomy examined by cryomicrotome section. Influence of age, vertebral level, and disease. Reg Anesth. 1996;21:395-406.
- Reina MA, Franco CD, López A, De andrés JA van Zundert A. Clinical implications of epidural fat in the spinal canal. A scanning electron microscopic study. Acta Anaesth Belg. 2009;60:7-17.
- Reina MA, Pulido P, Castedo J, Villanueva MC, López A, De Sola R. Características y distribución de la grasa epidural normal. Rev Esp Anestesiol Reanim. 2006;53: 363-372.
- Reina MA, Pulido P, Castedo J, Villanueva MC, López A, De Sola R. La grasa epidural en diferentes patologías. Aportaciones de la resonancia magnética y posibles implicaciones en la anestesia neuroaxial. Rev Esp Anestesiol Reanim. 2007;54: 173-178.
- Reina MA, López A, Valente G, De Andrés JA. Espaço epidural e ligamentos meningo vertebrais. Rev Anest Reg Terap Dor. (Lisboa) 1998;15:7-12.
- Wadhwani S, Loughenbury P, Soanes R. The anterior dural (Hofmann) ligaments.
Spine 2004;29:623-627. - Reina MA, Pulido P, López A. El saco dural humano. Rev Arg Anestesiol. 2007; 65:167-184.
- Reina MA, De Andrés JA, López A. Subarachnoid and epidural anesthesia. En: Raj P, ed. Textbook of Regional Anesthesia. Philadelphia: Churchill Livingston; 2002. pp. 307-324.
- Reina MA, López A, De Andrés JA. Variación del espesor de la duramadre humana. Rev Esp Anestesiol Reanim. 1999;46:344-349.
- Reina MA, López A, Dittmann M, De Andrés JA. Análisis estructural del espesor de la duramadre humana por microscopía electrónica de barrido. Rev Esp Anestesiol Reanim. 1996;43:135-137.
- Reina MA, Dittmann M, López A, van Zundert A. New Perspectives in the Microscopic Structure of Human Dura Mater in the dorso lumbar region. Reg Anesth. 1997;22:161-166.
- Dittmann M, Reina MA, López A. Neue ergebnisse bei der darstellung der dura mater spinalis mittles rasterelektronenmikroskopie. Anaesthesist 1998;47:409-413.
- Reina MA, López A, Dittmann M, De Andrés JA. Análisis de la Superficie externa e interna de la Duramadre Humana por microscopía electrónica de barrido. Rev Esp Anestesiol Reanim. 1996;43:130-134.
- Reina MA, Villanueva MC, López A. Aracnoides trabecular, piamadre espinal humana y anestesia subaracnoidea. Rev Arg Anestesiol. 2008;66:111-133.
- Reina MA, López A, Machés F, Oscar De Leon Casasola, De Andrés JA. Electrón microcopy and the expansion of regional anesthesia knowledge. Tech Reg Anesth Pain Management (New York) 2002;6:165-171.
- Reina MA, López A, De Andrés JA. Hipótesis sobre las bases anatómicas del síndrome de cauda equina e Irritación Radicular Transitoria post anestesia espinal. Rev Esp Anestesiol Reanim. 1999;46:99-105.
- Reina MA, Machés F, López A, De Andrés JA. The ultrastructure of the spinal arachnoid in humans and its impact on spinal anesthesia, cauda equina syndrome and transient neurological síndrome. Tech Reg Anesth Pain Management 2008;12:153-160.
- Reina MA, De Leon Casasola O, Villanueva MC, López A, Maches F, De Andrés JA. Ultrastructural findings in human spinal pia mater in relation to subarachnoid anesthesia. Anesth Analg. 2004;98:1479-1485.
- Reina MA, López A, De Andrés JA. Perforaciones naturales en la piamadre humana. Rev Esp Anestesiol Reanim. 1998;45:4-7.
- Reina MA, Villanueva MC, Machés F, Carrera A, López A, De Andrés JA. Ultrastructure of human spinal root cuffs in lumbar spine. Anesth Analg. 2008;106:339-344.
- Reina MA, Villanueva MC, López A, De Andrés JA. Grasa dentro de los manguitos durales de las raíces nerviosas de la columna lumbar humana. Rev Esp Anestesiol Reanim. 2007;54:169-172.
- Reina MA, López A, De Andrés JA, Villanueva MC, Cortés L. ¿Existe el Espacio Subdural?. Rev Esp Anestesiol Reanim. 1998;45:367-376.
- Reina MA, De León Casasola OA, López A, De Andrés JA, Mora M, Fernández A. The origin of the spinal subdural space. Ultrastructure finding. Anesth Analg. 2002;94:991-995.